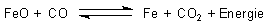
Das heterogene Gleichgewichtssystem FeO/CO und das Boudouard-Gleichgewicht
Experimente:
Versuch: Reduktion von Eisenoxid mit Kohle
Versuch: CO reduziert Eisenoxid
Eisenoxid wird im Hochofen durch Kohlenstoffmonoxid reduziert (->
Versuch). Über die Vorgänge berichten wir auf einer
besonderen Webseite. Die im Hochofen ablaufenden Reaktionen
sind ein Beispiel für die thermodynamische Betrachtungsweise von
Gleichgewichtsprozessen. Denn dabei stellen sich chemische Gleichgewichte ein. Das wichtigste
Gleichgewicht ist
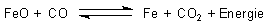
Die Gleichgewichtskonstante ist unter der Berücksichtigung des Umstands, dass die Aktivitäten der festen Phasen nicht berücksichtigt werden, wie folgt definiert:
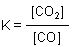
Bei den Konzentrationen handelt es sich um die Gleichgewichtskonzentrationen. Für die Freie Energie gilt unter Berücksichtigung der Restreaktionsarbeit:
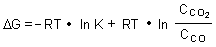
Diese Konzentrationswerte sind nun frei wählbar, wodurch die Wirtschaftlichkeit des Unternehmens "Hochofenprozess" gesteuert werden kann.
Wählt man das Verhältnis CCO2 / CCO kleiner als K, so verschiebt sich das
Gleichgewicht nach rechts. Es wird also bevorzugt Eisenoxid reduziert und dabei
CO2 gebildet.
Wird das Verhältnis CCO2 / CCO dagegen größer als K, so verschiebt sich das
Gleichgewicht nach links. Es wird also bevorzugt Eisenoxid zurückgebildet und
dabei CO gebildet.
Zur Effektivitätssteigerung ist es also am besten, den Wert des
Konzentrationsquotienten in der Restreaktionsarbeit besonders niedrig zu halten.
Man wird also dafür sorgen müssen, dass CO2 ständig aus dem Gleichgewicht
verschwindet. Dann nimmt CCO2 ab, der Wert des Konzentrationsquotienten sinkt.
Noch besser wirkt sich aus, dass man einen Weg gefunden hat, einen Teil des CO2
in CO zurückzuverwandeln. Dann sinkt nicht nur die Konzentration von CO2,
sondern zusätzlich nimmt die von CO zu. Damit wird das Konzentrationsverhältnis
noch kleiner. Das geschieht tatsächlich mit Hilfe des im Hochofen parallel
ablaufenden Boudouard-Gleichgewichts.
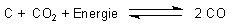
(Zur graphischen Darstellung der Konzentrations-Temperaturkurve dieses Gleichgewichts klicke hier.)
Dieses wiederum wird vorangetrieben, indem man ständig das gebildete CO aus dem Gleichgewicht abzieht - zur Reduktion von Eisenoxid. Verbraucht wird beim ganzen Prozess deshalb eigentlich nur die Kohle bzw. der Kohlenstoff, weshalb man auch gern etwas ungenau sagt, dass man mit Kohle Eisenoxid reduziert...
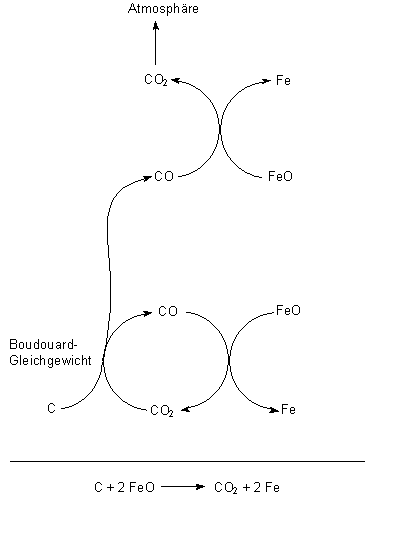
Das überschüssige CO2 wird mit etwas CO und Stickstoff als Gichtgas ausgestoßen.
Ständig werden Kohle und Eisenoxid nachgeschoben. Durch das alles wird ein
günstiges (weil kleines) CCO2
/ CCO-Verhältnis aufrechterhalten.
Einmal angeworfen brennt ein Hochofen monatelang. Man spricht hier treffend von
einem Fließgleichgewicht, das allerdings nicht die Komplexität von
biologischen Fließgleichgewichten hat. Fließgleichgewichte
zeichnen sich dadurch aus, dass sich ihre Abläufe fern vom chemischen Gleichgewicht bewegen.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“