Warum sind Enzyme so hochwirksame Katalysatoren?
Experimente:
Versuch: Mit Enzymen geht es auch ohne Kochen
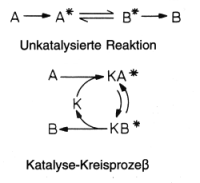
Katalysatoren sind Teilnehmer als einem Kreisprozess.

Die Zwischenverbindungen KA* und KB* sind aktivierte Komplexe. Wenn die Reaktionsenthalpie D HR und die Aktivierungsenergie gering sind, kann der Kreisprozess auch in der anderen Richtung durchlaufen werden. Katalysatoren verschieben folglich Gleichgewichte nicht; sie sorgen nur für deren raschere Einstellung. Je mehr Zwischenschritte eingelegt werden, desto geringer wird die aufzuwendende Aktivierungsenergie. Dies ist bei den Enzymkatalysen realisiert:
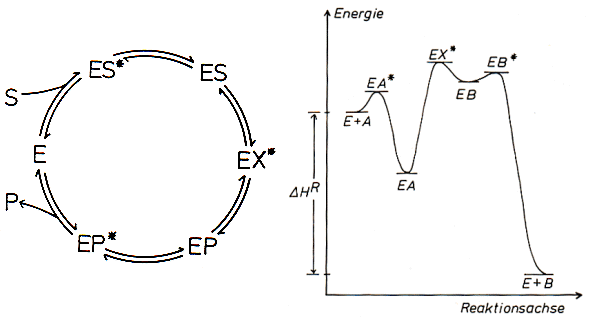
Der Übergangszustand, bei dem aus einem Substrat S das Produkt P wird, hat ein hohes Potential. Dagegen sind die ES- sowie EP-Komplexe im engeren Sinne nicht aktiviert; ihre Energie weist folglich ein Minimum auf. Die Geschwindigkeit der Gesamtreaktion hängt nur davon ab, wie schnell sich der Komplex EP über den Potentialwall von EP* zu bewegen vermag. Je mehr unterschiedliche Katalyseschritte bei einer Reaktion S -> P eingesetzt werden und je mehr Zwischenschritte eine einzelne Katalysereaktion aufweist, desto isothermer und zugleich reversibler ist der Reaktionsablauf. Man vergleiche zum Beispiel den biochemischen oxidativen Abbau der Glucose mit deren direkter Verbrennung. Auf diesem Wege kann die Reaktionsenthalpie D HR ohne größere irreversible Wärmeverluste portionsweise als (chemische) freie Energie D G (zum Beispiel durch ATP-Synthese aus ADP + P) abgefangen werden. Eine solche Reaktionskette ist besser steuer- und regelbar als beispielsweise eine direkte Verbrennung. So liegen bei den meisten Enzymen noch viel mehr Zwischenschritte vor, wie man schon am komplizierten Reaktionsmechanismus der ADH erkennen kann.
Ein Grund für die hohe katalytische Wirksamkeit der Enzyme liegt vor allem in der Geometrie des Makromoleküls und vor allem des aktiven Zentrums. Die Aktivität des Enzyms hängt dabei von der relativen Lage und vom Zustand der katalytisch wirksamen Punkte im substratbindungs- bzw. aktiven Zentrum ab. Durch diese werden die Substrate sterisch so ausgerichtet, dass die eigentliche Reaktion durch die Überlappung der Molekülorbitale von Substrat, Cosubstrat und Enzym eingeleitet werden kann. Bei der Oxidation von Ethanol mit NAD+ wird durch die ADH der Wasserstoff simultan als Hydrid-Ion (H-) und als Proton (H+) abgespalten:
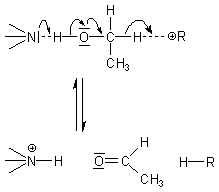
Dieser Elektronenfluss beim Wechsel von fünf Bindungen („Mehrzentrenreaktion")
erfordert eine sterisch präzise Ausrichtung der CH2OH-Gruppe.
Übrigens entspricht der hochgeordnete Wasserstoff-Ionen-Übergang von Ethanol auf
NAD+ und die ADH dem Zustand EX* in den obigen Bildern.
Aber auch die Urease ist ein Beispiel für exakte sterische Ausrichtung des Substrats Harnstoff.
Weitere Texte zum Thema „Katalyse“
Nach [7]