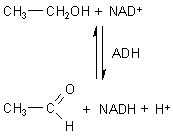
Der Reaktionsmechanismus der Alkoholdehydrogenase (ADH)
Die ADH ist das erste Enzym im Katalog der Enzym-Kommission. Es trägt die Nummer EC 1.1.1.1, heißt mit systematischem Namen Alkohol:NAD-Oxidoreduktase und katalysiert die Redoxreaktion zwischen Alkohol und Nicotinsäureamiddinucleotid NAD+.
Dabei zeigt es eine Gruppenspezifität gegenüber der homologen Reihe der Alkohole.
Ausnahme: Methanol wird nicht umgesetzt.
Eine praktische Anwendung der ADH soll nicht unerwähnt bleiben: Mit ihr führte man
langezeit Blutalkoholtests durch. Heute gibt es andere Methoden,
die zwar nicht genauer sind, die aber schneller gehen.
Vollständige Alkoholoxidation erhält man aber nur, wenn die Produkte
weiterverbraucht werden. In der Leber geschieht dies durch die
Aldehyddehydrogenase AlDH. Lies dazu unsere Webseite.
Im ADH-Enzymtest fängt man den Aldehyd durch eine chemische Reaktion ab, zum Beispiel
durch Oximbindung.
Die Reduktion von Aldehyden ist jedoch wahrscheinlich die bedeutendere Aufgabe
der ADH. Das betrifft vor allem das Vitamin A, das bekanntlich ein Aldehyd ist. Die
Speicherform von Vitamin A in der Leber ist aber ein Vitamin A-Ester mit einer
langkettigen Fettsäure. Dazu muss Vitamin A zuvor zum Alkohol reduziert werden. Das
macht die ADH. Weiter wird auch Glycerinaldehyd, der aus dem Abbau von Fructose
stammt, durch die ADH reduziert.
Bei der ADH handelt es sich um ein Metallo-Enzym. Es trägt im aktiven Zentrum, das mit dem Anlagerungszentrum identisch ist, ein komplex (koordinativ) gebundenes Zink-Ion.
Der Grundmechanismus der enzymatischen Alkoholoxidation
Eine Ursache für die hohe katalytische Wirksamkeit der Enzyme liegt bekanntlich vor
allem in der Geometrie des Makromoleküls. Die Aktivität des Enzyms hängt dabei von
der relativen Lage und vom Zustand der katalytisch wirksamen Punkte im
Substratbindungs- bzw. aktiven Zentrum ab. Durch diese werden die Substrate
sterisch so ausgerichtet, dass die eigentliche Reaktion durch die Überlappung der
Molekülorbitale von Substrat, Cosubstrat und Enzym eingeleitet werden kann. Bei der
Oxidation von Ethanol mit NAD+ wird der Wasserstoff simultan als Hydrid-Ion (H-) und
als Proton (H+) abgespalten. Diese Reaktion ist reversibel.
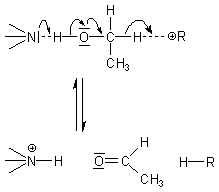
Dieser Elektronenfluss beim Wechsel von fünf Bindungen („Mehrzentrenreaktion") erfordert eine sterisch präzise Ausrichtung allein der CH2OH-Gruppe. Wie das geschieht, beleuchten wir im folgenden Abschnitt. Dort erhalten wir auch die Erklärung dafür, warum Methanol nicht reagiert.
Der Katalyse-Mechanismus der ADH
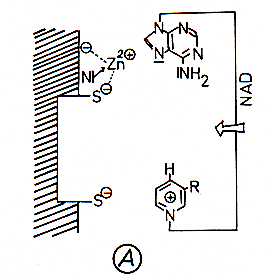
A Die ADH enthält ein an eine S--Gruppe
gebundenes Zn2+-Ion, das zusätzlich koordinativ fixiert ist. Dieses Zn2+-Ion
bindet den Adenin-Teil des NAD+-Moleküls. Der Nicotinsäureamid-Teil wird wegen
seiner positiven Ladung an eine weitere S--Gruppe des Enzyms sterisch fixiert.
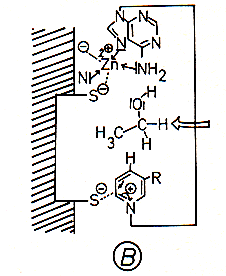
B Das herandiffundierende Ethanolmolekül wird mit seinem Sauerstoffatom koordinativ an die sechste Bindungsstelle des Zn2+-Ions und mit dem Wasserstoffatom des OH-Restes an die Aminogruppe des Adenins gebunden; dabei wird die Bindung zwischen dem Sauerstoff- und Wasserstoffatom gelockert.
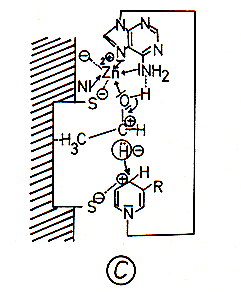
C Die lipophile Methylgruppe des Ethanols (die beim Methanol fehlt) ist über Van der Waals-Kräfte an unpolare Reste des Enzyms, die eine lipophile Tasche bilden, gebunden. Diese Fixierung des Alkoholmoleküls bewirkt eine enge Nachbarschaft des mit dem Sauerstoffatom verbundenen Kohlenstoffatoms zum positiv geladenen Nicotinsäureamidrest von NAD+. Dadurch wird der Übergang eines Hydrid-Ions zum NAD+-Molekül ermöglicht.
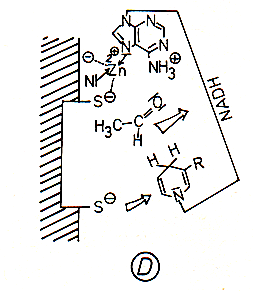
D Die am Ethanolmolekül zurückbleibende positive Ladung wird durch Abstoßen des
Hydroxyl-Wasserstoffs als Proton eliminiert; diese wird zunächst durch die
Aminogruppe des Adenins und anschließend durch das Puffersystem der Zelle
abgefangen. Damit entstehen Acetaldehyd und NADH/H+.
Die Abstoßung der Produkte muss nicht notwendigerweise erfolgen, denn dieser
Mechanismus kann auch rückwärts laufen. Nur dann, wenn die Produkte
weiterverbraucht werden, läuft die Reaktion ständig in Richtung auf Alkoholoxidation.
Für den besprochenen Mechanismus gibt es viele Hinweise
1 Die Zink-Ionen spielen eine wichtige Rolle bei der Katalyse
2 Es sind Thiolgruppen beteiligt
3 Das pH-Optimum der ADH liegt bei 9,5.
Das hat zwei Gründe:
Da der pKs-Wert der SH-Gruppe 8 beträgt, liegt bei diesem pH-Wert der größte Teil
dieser Gruppen dissoziiert als Anion R-S- vor. Das sind die Bindungsstellen für Zn2+
und für NAD+.
Oberhalb vom pH-Wert 9,5 bildet sich an den beiden freien Koordinationsstellen
Zn(OH)2, damit sinkt die Aktivität des Enzyms wieder.
4 Der Wasserstoff im NADH stammt aus der C-H-Bindung der Hydroxymethyl-Gruppe
5 Eine lipophile Tasche des Enzyms ist beteiligt
Weitere Texte zum Thema „Katalyse“
Nach [7]