
Die einfachste Aminosäure - Aminoessigsäure. Vergleich mit
g-Aminobuttersäure
Experimente:
Versuch: Reagiert Glycin sauer? (Isoelektrischer Punkt)
Versuch: Einfache Elementaranalyse von Glycin
Versuch: Van Slyke-Probe zum Nachweis von Aminen
Versuch: Glycin als Komplexligand
Versuch: Vergleich der Titrationskurven von Glycin und 4-Aminobuttersäure
Glycin ist die einfachste Aminosäure. Deren Name kommt vom griechischen glykos,
süß. Wenn wir die Substanz ausnahmsweise mal probieren, bestätigt sich ihr Name:
Sie schmeckt kräftig süß - wie Saccharose. Das erstaunt, soll es sich beim Glycin doch um eine Säure handeln!
Zunächst prüfen wir deshalb, ob wässrige Glycinlösungen sauer reagieren (-> Versuch). Ihr pH-Wert liegt bei 5,92. Und wenn wir bei der Geschmacksprobe genau darauf achten, stellen wir Folgendes fest: Glycin hat einen leicht säuerlichen Nachgeschmack. Das ganze erinnert ein wenig an den Geschmack von Brausepulver...
Die Halbstrukturformel von Glycin ist H2N-CH2-COOH.

Bild 1: Kalottenmodell des Glycins
(Foto: Blume)
Ihre chemische Bezeichnung ist Aminoessigsäure. Wo andere Aminosäuren
einen Rest "R" tragen, befindet sich beim Glycin nur ein Wasserstoffatom ("R = H").
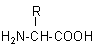
Allgemeine Strukturformel von Aminosäuren
Glycin ist aufgrund der zwei H-Atome am C-Atom 2 nicht einmal optisch aktiv - anders als die anderen Aminosäuren.
Zur einfachen Elementaranalyse von Glycin (-> Versuch) können wir eine Probe mit Kupfer(II)-oxid umsetzen und die Reaktionsprodukte Wasser und Kohlenstoffdioxid nachweisen.
H2N-CH2-COOH + 3 CuO ———> 2 CO2 + H2O + NH3 + 3 Cu
Nachweis der Aminogruppe
Beim Erhitzen oder Verbrennen von Glycin entwickelt sich im Rahmen der einfachen Elementaranalyse Ammoniak
(-> Versuch). Wir können auch eine Probe des Glycins mit einer Perle von
Natriumhydroxid versetzen und erwärmen.
Es gibt aber noch eine elegantere Reaktion, die van-Slyke-Probe (->
Versuch). Hierbei säuern wir eine Glycinlösung schwach an und geben etwas Nitrit zu.
Es entwickelt sich ein Gas: Stickstoff. Die Reaktion verläuft über ein Diazonium-Kation, das instabil ist und Stickstoff
freisetzt.
 |
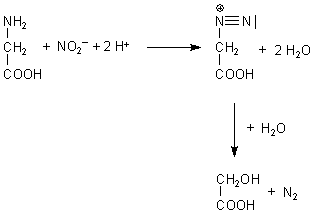 |
| Bild 2: Reaktion nach van Slyke
(Foto: Daggi) |
Glycin bildet Salze und Komplexe
Einmal kann Glycin wie jede Säure Salze bilden. Das braucht hier nicht weiter erörtert zu werden.
Eine andere Möglichkeit zur Bindung von Metall-Ionen ist die Ausbildung von Komplexbindungen. Darauf beruhen schöne Farbreaktionen.
| 1. | Mit Kupfer(II)-Ionen beobachten wir ein intensives Blau (-> Versuch). Beim tiefblauen Komplex handelt es sich um eine Verbindung aus einem Kupfer-Ion und zwei Glycinmolekülen als Liganden. |
 |
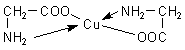 |
| Bild 3: Kupfer-Glycin-Komplex
(Foto: Daggi) |
| 2. | Auch mit Eisen(III)-Ionen bildet sich ein Komplex, der allerdings tiefrot ist. Glycin-Eisen(II)-Komplexe sind zum Beispiel in Medikamenten zur Eisenversorgung enthalten. |

Bild 4 (Foto: Daggi)
Glycin bildet Zwitter-Ionen
Glycin ist eine Festsubstanz. Ihr Schmelzpunkt ist mit 233 °C recht hoch, wobei sie sich allerdings rasch zersetzt
(-> Versuch). Das müssen wir einmal mit dem Schmelzpunkt der Essigsäure (16,5 °C) vergleichen!
Ein derartig hoher Schmelzpunkt ist für eine organische Substanz, die aus kleinen Molekülen besteht, erstaunlich.
Hinzu kommt, dass es sich hier um ein Molekülgitter handelt. Im Glycingitter liegen tatsächlich identische Glycinmoleküle
vor. Aber die werden nicht wie bei organischen Molekülen normal durch van der Waals-Bindungen oder Wasserstoffbrücken
zusammengehalten. Hier geht es um elektrostatische Kräfte, die zu den Bindungen im Kristall führen.
Glycin liegt im Kristall bereits dissoziiert vor. Dabei wandert das Proton des Carboxylrests R-COOH innerhalb eines Moleküls zur benachbarten Aminogruppe R-NH2. Wir sprechen von Zwitter-Ionen.
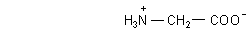
Man muss sich das intramolekular gebildete Zwitter-Ion als ringförmiges Molekül vorstellen. Es handelt sich um ein intramolekulares Säure/Base-Gleichgewicht.
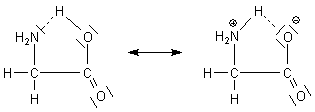
Zwitter-Ion von Glycin
Jetzt verstehen wir den hohen Schmelzpunkt von Glycin: Glycinkristalle sind aus Ionen aufgebaut. Ionengitter sind im
Allgemeinen stabiler als Molekülgitter.
Nun dürfen wir den Aufbau des Glycinkristalls aber nicht etwa mit dem eines Natriumchloridgitters
vergleichen. Bei letzteren liegen die Kationen und Anionen getrennt als Natrium- bzw. Chlorid-Ionen vor. Im Glycinkristall
finden wir Moleküle, die gleichermaßen Kationen und Anionen sind.
Der ionische Aufbau der Reinsubstanz ist auch der Grund für die Geruchlosigkeit des Glycins. Erinnern wir uns: Amine und
Essigsäure stinken gleichermaßen...
Die pK-Werte des Glycin-Systems bestätigen das Modell
Wir vergleichen Glycin mit zwei ähnlichen Verbindungen: Essigsäure und Methylamin. Denn beide sind sozusagen ein
zertrenntes Glycinmolekül.
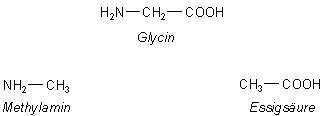
Der Nachbarschaftseffekt von COOH und NH2 im Glycinmolekül
sollte zur Folge haben, dass die zwei pKa-Werte von Glycin von denen der Essigsäure bzw. von Methylamin stark abweichen.
Aus bestimmten Gründen, die wir gleich verstehen werden, nehmen wir in die Tabelle auch die Daten der 4-Aminobuttersäure auf.
| pKa | |
| R-COOH
Essigsäure Glycin 4-Aminobuttersäure |
4,75 2,27 (pk1) 4,03 (pk1) |
| R-NH2
Methylamin Glycin 4-Aminobuttersäure |
10,66 9,78 (pk2) 10,56 (pk2) |
Beim Vergleich der pKa-Werte in der Tabelle erkennen wir, dass im Glycin die Carboxylgruppe deutlich saurer geworden
ist als die von Essigsäure. Der Nachbarschaftseffekt einer Base bewirkt also, dass sich das Proton wesentlich leichter von der COOH-Gruppe
ablöst.
Die Aminogruppe des Glycins ist weniger basisch als die von Methylamin. Aufgrund der Wasserstoffbrückenbindung ist das
freie Elektronenpaar, das für die Basizität des Stickstoffs verantwortlich ist, nicht so leicht verfügbar. Damit
sinkt auch der pKa-Wert des Amins. Das heißt, es muss ein höherer Protonendruck herrschen, um die Aminogruppe
des Glycins zu protonieren.
Der isoelektrische Punkt
Mit Hilfe der pKa-Werte können wir auch ausrechnen, wo ungefähr der pH-Wert einer Lösung von Glycin liegen sollte.
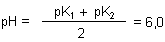
Das Ergebnis können wir leicht überprüfen (-> Versuch).
Den so definierten pH-Wert nennt man den isoelektrischen Punkt. Bei dem halten sich die "Konzentrationen" an Plus- und Minusladungen im Molekül die Waage. Der Begriff stammt aus der Methode der Elektrophorese. Bei der untersucht man, wie Ionen unter Einwirkung eines elektrischen Felds wandern. Bei Aminosäuren variiert man dazu den pH-Wert der Lösung. Wenn die Zahl der Plus- sowie der Minus-Ladungen in einem Molekül gleich ist, unterbleibt die Wanderung. Die Moleküle bleiben förmlich "stehen". Daraus hat man früher auf den Aufbau der Aminosäure geschlossen.
Zum isoelektrischen Punkt haben wir eine besondere Webseite.
Die potentiometrische Titrationskurve des Glycins
Genauere Informationen zum Dissoziationsverhalten von Säuren oder Basen erhalten wir, indem wir potentiometrische
Titrationskurven aufnehmen.
Hier gibt es eine kleine Schwierigkeit: Wenn wir zum Beispiel eine Lösung von Glycin titrieren wollen, so gehen wir von
einer Lösung mit pH-Wert um 6 aus, also vom isoelektrischen Punkt.
Um die dissoziierte Carboxylgruppe R-COO- zu erfassen, müssen wir als Titriermittel Salzsäure zugeben.
NH3+-CH2-COO- + HCl ———> NH3+-CH2-COOH + Cl-
Um dann auch noch die protonierte Ammoniumgruppe R-NH3+ zu erfassen, müssen wir in einem zweiten Ansatz als Titriermittel Natronlauge zugeben.
NH3+-CH2-COO- + NaOH ———> NH2-CH2-COO- + Na+
Aus den zwei Kurventeilen können wir die gesamte Titrationskurve zusammensetzen.
Das ist alles sehr umständlich. Damit wir aber die gesamte Titrationskurve von Glycin in einem Rutsch erhalten, müssen wir Glycin zuvor in die zweibasige Form AH2 überführen. Da dem Glycin ein Proton fehlt, lösen wir die Aminosäure vor der Titration statt in Wasser in Salzsäure!
NH3+-CH2-COO- + HCl ———> NH3+-CH2-COOH + Cl-
Natürlich muss die Salzsäure die gleiche Molarität wie das Glycin haben. Jetzt können wir mit Natronlauge titrieren (-> Versuch).
| Klick mich an! |
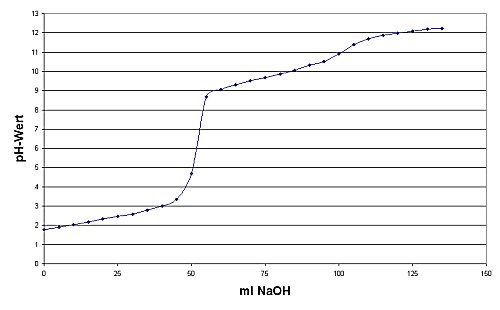 |
| Titrationskurve von Glycin
(Bedingungen siehe Versuch) |
Wir vergleichen das Ganze mit der Titrationskurve der Essigsäure.
Demnach sollten wir eigentlich von Anfang an zunächst einen steilen Anstieg der Kurve sehen, der dann zu
einem flachen Wendepunkt bei pH 2,3 und 25 ml Zugabe an Lauge abbiegt: pK1. Dieser Wendepunkt
ist nicht zu erkennen, weil sich bei diesem niedrigen pH-Wert noch das hochkonzentrierte Puffersystem H3O+
/ H2O mit seinem pKa-Wert -1,74 glättend auswirkt. Bei pH 9,8 sowie 75 ml Zugabe finden wir
erwartungsgemäß den zweiten Wendepunkt: pK2. Hier wirkt das zweite hochkonzentrierte Puffersystem des
Wassers H2O / OH- mit seinem pKa-Wert 15,74 noch nicht. Zwischen pK1
und pK2 des Glycins liegt bei pH 6 der Halb- Äquivalenzpunkt. Dieser ist zugleich der isoelektrische Punkt.
Zum Vergleich: Titration von 4-Aminobuttersäure
Zum besseren Verständnis dient auch die Titration von 4-Aminobuttersäure (im Laborjargon g-ABu
oder GABA genannt) (-> Versuch).
Bei der GABA ist der Nachbarschaftseffekt zwischen Carboxyl- und Aminogruppe auf Grund der räumlichen Entfernung nicht so ausgeprägt wie beim Glycin. Folglich sollten sich die pKa-Werte gegenüber Essigsäure und Amin weniger verändern als beim Glycin. Tatsächlich ergibt die Titration, dass GABA weniger sauer (pK1 = 4,03) und stärker basisch reagiert (pK2 = 10,56) als Glycin. Letztlich reagieren beide wie isolierte Moleküle, die nichts voneinander wissen, also wie gelöste Essigsäure und Methylamin. In Lösung liegt GABA deshalb nicht so ausgeprägt zwitter-ionisch vor wie das Glycin.
| Klick mich an! |
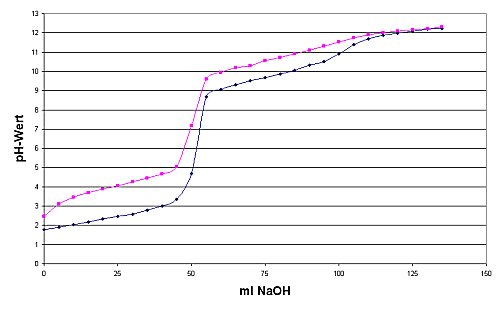 |
| Titrationskurven von Glycin (blau) und 4-Aminobuttersäure (rot)
(Bedingungen siehe Versuch) |
Eines bedarf noch der Klärung:
Der Schmelzpunkt von GABA ist mit 203 °C allerdings immer noch recht hoch. Das weist auf ionische Bindungen im Kristallgitter
hin. In den Kristallen findet tatsächlich ein Protonentransfer statt, diesmal aber intermolekular. Deshalb gibt es auch hier
Zwitter-Ionen. Darauf weist auch die Geruchlosigkeit der Substanz hin - verglichen mit Buttersäure!
Übrigens: Es gibt auch eine 2-Aminobuttersäure. Deren Schmelzpunkt ist 304 °C, die pKa-Werte liegen bei denen
des Glycins.
Glycin als Proteinbestandteil
Glycin ist eine sehr häufig vorkommende Aminosäure, die in einem Protein wenig "aufträgt". Denn ihre Struktur ist wegen
fehlenden Rests R ausgesprochen platzsparend und macht deshalb Glycin zu einer Aminosäure, die besonders in Proteinen eingebaut
wird, die mechanische Aufgaben haben. Das wichtigste Beispiel ist das Kollagen, aus dem Sehnen und Bänder
aufgebaut sind. Dieses Struktur-Protein enthält zu 35 % Glycin und zu 21 % Prolin (sowie Hydroxyprolin). Typisch ist die
Aminosäure-Sequenz Gly-X-Pro (oder HO-Pro). X steht für eine beliebige andere Aminosäure.
Kollagen besteht aus Helices (Spiralen), von denen noch einmal drei zu einem einzigen "Seil" verdrillt sind. Helices
sind so aufgebaut, dass die Reste der Aminosäuren nach außen ragen. Zwischen den Spiralen darf kein großer Zwischenraum
sein, sonst ist der Zusammenhalt der drei zu einer Superhelix zu gering. Sehr enge Berührungspunkte erlaubt deshalb die
restfreie Aminosäure Glycin.
Aus Kollagen gewinnt man Gelatine. Die hat zwar interessante mechanische Eigenschaften, ist aber wegen des Gehalts an "minderwertigen" Aminosäuren bezüglich des Ernährungswerts uninteressant.
GABA - eine wichtige Aminosäure
Nun wollen wir schnell noch sagen, welche Rolle GABA spielt.
4-Aminobuttersäure ist zwar eine Aminosäure, aber nicht beteiligt am Aufbau von Peptiden oder Proteinen. GABA spielt
im Stoffwechsel des Zentralnervensystems eine wichtige Rolle. Sie ist ein inhibitorischer Transmitter (Ganglienblocker).
Bemerkenswert ist, dass sie im Gehirn durch Decarboxylierung aus Glutamat gebildet wird. Letzteres ist ein aktivierender
Transmitter. Bekannt ist Glutamat als Auslöser des Chinarestaurant-Syndroms. Glutamat ist in der bekannten braunen Sauce,
die zu chinesischen Speisen serviert wird, enthalten. Leute, die zuviel davon essen, bekommen Schweißausbrüche und
vielleicht sogar einen Kreislaufkollaps.
So macht es Sinn, dass GABA als sedierende (beruhigende) Verbindung aus dem Abbau des aktivierenden Glutamats entsteht: Dadurch wird nicht nur die Konzentration des Glutamats gesenkt, sondern zugleich auch die Wirkung des Glutamats ausgebremst.
Zum Glutamat lies auch die Frage/Antwort 1314.
Weitere Texte zum Thema „Essig“