Prof. Blumes Tipp des Monats September 2005 (Tipp-Nr. 99)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Strukturiertes Wasser - Von Gelatine
und Polysacchariden bis zu den Superabsorbern


Bild 1 (Fotos: Daggi)
Was gibt es Schöneres für die Sommerzeit als gekühlte Götterspeise mit Vanillesauce?
Auch Windeln tragende Babys essen die gerne. Was haben Götterspeise und Babywindeln gemeinsam?
Hinter ihnen stecken chemische Verbindungen, welche große Mengen an Wasser zu binden vermögen.
Dabei bildet sich Glibberzeugs - oder ein Gel, wie der Chemiker sagt. Die wasserbindenden,
chemischen Verbindungen nennt er Gelbildner. Bei besonders effektiven spricht
er auch von Superabsorbern. Und wenn es sich (wie in unseren Beispielen) um
Gele auf Wasserbasis handelt, nennt er diese Hydro-Gele.
Gleich vorneweg: Es handelt sich bei der Erforschung der Gelstrukturen und der davon abhängenden Eigenschaften um eine sehr komplizierte Chemie-Sparte! Das soll uns aber nicht abschrecken, uns damit zu befassen.
Alle gelbildenden Verbindungen sind aus Makromolekülen aufgebaut. Sie bilden lange, mehr oder weniger vernetzte Molekülketten und Molekülnetze.
Da ist zunächst der Klassiker, die Gelatine. (Zur Herkunft der Bezeichnung klicke hier.)
|
Versuch 1: Gele aus Gelatine hergestellt
|

Bild 2: Gelatinegele entsprechend Versuch 1
(Foto: Daggi)
Gelatine ist eigentlich nicht sonderlich appetitlich: Sie ist nichts anderes als
ausgekochte Knochen- oder Sehnenmasse. Chemisch ist sie ein Protein. (Zur Gelatine-Herstellung
klicke hier.)
|
Versuch 2: Gelatine ist ein Protein
|

Bild 3: Links Kupfersulfatlösung; rechts Biuretprobe
(Foto: Daggi)
Gelatine ist nicht nur als wasserbindende Substanz für Götterspeise oder andere Lebensmittelzubereitungen
wichtig. Viele Gelatinearten benötigt man für eine Reihe von technischen Anwendungen. Mit Gelatine
beschichtet man zum Beispiel auch Filmmaterial. Gelatine wirkt hierbei nicht nur als Träger für die
lichtempfindliche Emulsion, sondern selbst als Emulgator für Silberbromid, der für feine Verteilung der
Silberbromidkristalle sorgt. Darüber hinaus stabilisiert sie sogar noch die Emulsion. Man spricht von
einem Schutzkolloid. Der verhindert nämlich das Zusammenbacken von Silberbromid und damit die Bildung
größerer Kristalle, was zu einer störenden Grobkörnigkeit des Bildes führen würde. Zum diesbezüglichen
Einsatz von Gelatine haben wir in unserem Webseitenbereich zur "Chemie des fotografischen Prozesses" einen
Text mit Versuchsvorschriften.
Wie muss man sich die Struktur eines Gels vorstellen?
Zunächst einmal handelt es sich bei den Gelbildnern um polare Substanzen. Sie sind in der Lage, mit den
Dipolen des Wassers Bindungen auszubilden:
Wasserstoffbrückenbindungen oder (wenn sie geladen sind) Ion-Dipol-Bindungen. Die primär fixierten Wassermoleküle
bilden Bindungen zu weiteren Wassermolekülen aus. Auf diese Weise können die Gelbildner große Mengen an Wassermolekülen
um sich herum gruppieren und festhalten.
Die langen Molekül-Ketten liegen im Gel mehr oder weniger verschlungen vor. Dabei können sich auch stabilisierende Doppelhelices bilden, wie wir sie von der DNA her kennen. Dass nicht das gesamte Polymergemisch zur Doppelhelix wird, liegt daran, dass es alternierende, feine Unterschiede in der Struktur der Gelbildnermoleküle gibt. Damit können sich verschlungene, weitmaschige Netze aufbauen.
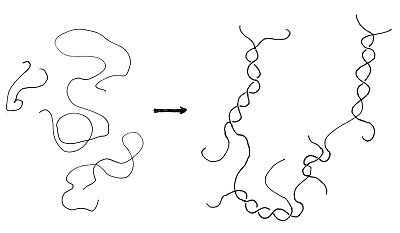
Außerdem werden durch die Weitmaschigkeit die wasserbindenden Gruppen der Gelatine mit großen Mengen an Wasser in
Kontakt gebracht. Gelbildnernetze schließen das Wasser regelrecht ein. Wir sprechen von strukturiertem
Wasser. Die Wassermoleküle sind manchmal sogar so fest gebunden, dass sie auch unter äußerem Druck nicht
abgegeben werden. Deshalb fühlt sich wasserärmeres Hydro-Gel oftmals sogar trocken an.
Solche Gele sind elastisch, wie wir es von der Götterspeise her kennen. Auch das kann man erklären. Die Strukturen,
die wir eben beschrieben haben, sind nämlich nicht so starr wie in einem Eiskristall angeordnet, sondern flexibel
und schwingungsfähig. Auch sind die Wassermoleküle nicht völlig unbeweglich. Als Modell könnt ihr euch ein
Kletterseil-Gerüst auf einem Spielplatz vorstellen. Die Seile sind die Molekülketten der Gelbildner, die Kinder
sind die Wassermoleküle.

Bild 4 (Foto: Blume)
Gele können wir wieder zerfließen lassen. Dazu brauchen wir sie nur zu erwärmen. Beim Abkühlen bilden sie sich
wieder zurück. Wichtig: Wir erwärmen in einem Wasserbad. Das dauert zwar etwas länger, wir laufen aber nicht Gefahr,
dass sich durch Überhitzen die gelbildende Substanz zersetzt.
|
Versuch 3: Gele erhitzen
|
Durch das Erwärmen fangen die Netze so stark an zu schwingen, dass sich die Wassermoleküle nicht mehr "festhalten" können. Das Gel zerfließt. Beim Abkühlen stellt sich die Ordnung wieder her.
Wir können manche Gele deshalb auch mechanisch zerstören, indem wir sie stark rühren. Das geht aber nur mit wirklich guten Rührmaschinen! Dann werden die Strukturen der Hydro-Gele zerschlagen, nicht aber die Makromoleküle!
Götterspeise ohne Gelatine?
Heute wird Götterspeise von den meisten Herstellern nicht mehr aus Gelatine gemacht. Grund ist die Furcht
der Verbraucher vor BSE. Mittlerweile greifen die Hersteller auf pflanzliche Polysaccharide zurück, zum
Beispiel auf Polysaccharide namens Carrageenane. Die bestehen letztlich vor allem aus
Galactoseresten. (Nicht erschrecken: Die Galactose ist überhaupt nichts Besonderes. Sie ist zum Beispiel
neben Glucose Bestandteil der Lactose und kann in unserem Körper leicht abgebaut werden.)
Wegen der vielen OH-Gruppen können Polysaccharide Wassermoleküle über Wasserstoffbrücken binden und auf diese Weise große Mengen an Wasser speichern. Dieses primär gebundene Wasser hat einen besonderen Effekt zur Folge.
Zuvor müssen wir aber noch etwas nachtragen: Carrageenane tragen (wie auch viele andere, wasserbindende Polysaccharide) darüber hinaus noch Sulfat- oder Carboxylatreste.
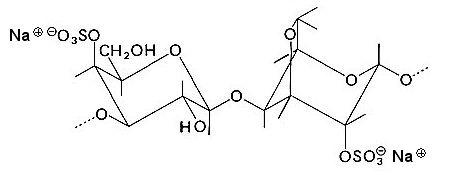
Carrageenan-Struktureinheit
Carrageenane sind also Anionengerüste. Bleibt noch die Frage, was die Gegen-Ionen zu
den Anionen-Gerüsten sind. Hier handelt es sich um Ammonium- sowie um Alkalimetall-Ionen.
Die Polysaccharide erinnern somit an einen beladenen Kationenaustauscher.
Allerdings werden hier keine Ionen ausgetauscht. Im ersten Schritt (die Aktivierung) werden bei Kontakt mit
Wasser die Kationen nur herausgelöst. An ihre Stelle treten Wasserdipole, die mit den anionischen Resten
über Ion-Dipol-Kräfte wechselwirken. Man kann das Ganze als eine Lösung von Kationen in Wasser bezeichnen,
das an einem riesigen Anionsystem fixiert ist. Es ist sozusagen eine strukturierte Salzlösung.
Die vielen eng benachbarten negativen Ladungen der Poly-Anion-Makromoleküle stoßen sich in dieser "Lösung" ab;
damit weiten sich die Strukturen auf. Es können auf diese Weise unglaublich viele Wassermoleküle fixiert werden.
Hinzu kommen noch strukturelle Eigenschaften, die diesen Effekt verstärken. Die wasserbindenden Polysaccharide
bauen (wie schon bei der Gelatine besprochen) verschlungene, weitmaschige Netze mit doppelhelicalen Bereichen auf.
Saure oder anionische Polysaccharide sind beileibe keine Technikprodukte. Carrageenane gewinnt man aus Rotalgen. Es gibt weitere Algenprodukte: Agar-Agar und Algine. Gummi arabicum gewinnt man aus einer Akazienart. Einige wasserspeichernde Polysaccharide sind bereits von vornherein in vielen unreifen Früchten wie Äpfeln und vor allem in Quitten enthalten. Sie heißen Pektine. Typisch für sie sind die Bausteine Galacturonsäure bzw. ihr Anion sowie ihr Methylester.
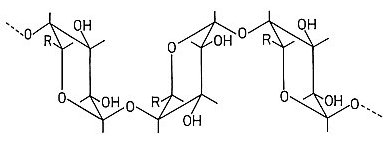
Pektin-Struktur (R: COO- oder COOCH3 )
Die eigentliche Aufgabe der Pektine in den Pflanzen ist die eines wasserbindenden Strukturbildners. Mit ihrer
Hilfe kochen wir aber auch die Gelees und Marmeladen, die wir auf dem Frühstücksbrötchen so lieben.
Reife Früchte haben weniger Pektine. Ihnen werden beim Zubereiten von Gelees pektinhaltige, käufliche
Gelierzucker zugesetzt. An deren Dosierungsvorschriften sollten wir uns unbedingt halten! Andernfalls
wird der Gelee zu flüssig oder zu fest.
|
Versuch 4: Untersuchen von Gelierzucker
|
Auch unsere Augäpfel enthalten strukturbildende Polysaccharide. Man nennt sie Mucopolysaccharide (mucidus ist das lateinische Wort für rotzig). Sie bilden zusammen mit speziellen Proteinen feine Netze, die das Wasser extrem binden. Augäpfel sind bekanntlich sehr hart, wie du selbst fühlen kannst. Das liegt nicht an der umgebenden Lederhaut-Hülle. Wenn man die entfernt, wird der Glaskörper des Auges freigelegt, der bezüglich seiner Eigenschaften an einen Flummi erinnert. Den Glaskörper können wir mit einem Schneebesen zerrühren bzw. zerschlagen. Dabei merken wir, dass der Glaskörper zu 98 % aus Wasser besteht! Wie der Name Mucopolysaccharide besagt, sind diese Stoffe auch bei der Bildung von Schleimen und Emulsionen beteiligt.
Sagenhaft ist auch der hohe Wassergehalt der Quallen. Die fühlen sich knackig fest an - vor allem wenn man drauftritt. Sie bestehen aber zu 99 % aus Wasser. Das erkennt man, wenn man beobachtet, wie die Quallen in der Sonne eintrocknen: Danach bleibt oft nur noch der runde Abdruck im Sand übrig. Den kann man sogar als Versteinerung finden.
Zur Erinnerung: Auch Stärke bildet Gele. Darauf beruht die Gewinnung der Stärkefolie. Hier beschreiben wir ihre Herstellung.
Nun zu den Babywindeln
Die modernen Babywindeln sind chemisches High-Tech. Wir erkennen solche Windeln an entsprechenden
Werbehinweisen wie zum Beispiel für "Fixies®" der Fa. Hartmann: "Mit Sensitive Care, den speziellen
Saugkügelchen, die Nässe und die hautirritierenden Stoffe des Urins sicher einschließen."
|
Versuch 5: Wasserspeichervermögen einer Babywindel
|
Beeindruckend! Allerdings ist die Windel deutlich schwerer geworden. Unser Baby hat also an seiner
Windel zu schleppen!
Unsere Mütter und Großmütter müssten uns eigentlich um diese Windeltechnologie beneiden. Die Werbung
mit echt trockengelegten Babys hält, was sie verspricht. Denn die Windeln enthalten wasserspeichernde
Gelbildner, die das Hundertfache ihres Gewichts an Baby-Pipi binden können. Man nennt sie Superabsorber.
Der Vorteil dieser Substanzen ist auch, dass sie neutral reagieren und physiologisch unbedenklich sind.
Trotz ihres sagenhaften Bindevermögens für Wasser sind sie nicht hygroskopisch; man kann die Windeln
also offen lagern.
Wo bekommen wir die tolle Substanz her? Die Firmen geben dem Vernehmen nach nur Portionen im Umfang
von mindestens 50 kg ab.
Warum also isolieren wir die wasserspeichernden Gelbildner nicht aus den Windeln?

Bild 5 (Foto: Daggi)
|
Versuch 6: Superabsorber
Etwa 1 g Superabsorberpulver geben wir in ein Becherglas (500 ml). Darauf gießen wir 50 ml destilliertes
Wasser und rühren kurz um. Etwas warten! Es bildet sich ein Gel.
|
Es ist schon merkwürdig: Das Gel enthält sichtlich eine Unmenge an Wasser, fühlt sich aber (bei nicht zu großen Wassermengen) richtig trocken an. Versuchen wir eine Erklärung.
Chemisch handelt es sich um das Natrium-Salz der Poly-Acrylsäure.
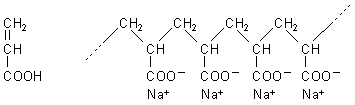
Strukturen von Acrylsäure und des Superabsorbers
Das Monomere (Acrylsäure) ist zunächst einmal linear vernetzbar. Durch Einbau von polyvalenten Monomeren kann
das Polymer auch Quervernetzungen enthalten.
Das Bau- und Funktionsprinzip ist uns schon bekannt: Das Netz gleicht denen der anderen wasserbindenden
Polyanionen wie den Carrageenanen. Letztlich hat man alle willkommenen Eigenschaften der natürlichen Gelbildner
zusammengefasst und technisch optimiert, was die Substanz zu einem Superabsorber macht. Die
Wassermoleküle sind hier sogar so fest gebunden, dass sie auch unter äußerem Druck nicht abgegeben werden.
Deshalb fühlt sich das Hydro-Gel zunächst immer trocken an.
Man hört immer wieder, dass die Superabsorber das Tausendfache ihres Gewichts an Wasser wegstecken können. Schön wär´s: Denn dann brauchte Babys Windel nur einmal in der Woche gewechselt zu werden... Allerdings ist Baby-Pipi kein destilliertes Wasser (wie es zur Demonstration der Wirksamkeit von Superabsorbern gern genommen wird), sondern enthält gelöste Salze. Untersuchen wir doch einmal, wie sich der Superabsorber gegenüber Salzlösungen verhält.
|
Versuch 8: Superabsorber und Salzlösungen
|

Bild 6: Superabsorber entsprechend Versuch 8
(Foto: Blume)
Auch das können wir erklären: Der erste Schritt der Funktion des Superabsorbers ist seine Überführung
in die aktive Form: Das erfordert die Ablösung der Natrium-Ionen und somit die Freisetzung und Entfaltung
des Poly-acrylat-poly-anions. Wenn aber in der Flüssigkeit von vornherein Natrium-Ionen gelöst sind, so wird
das Poly-Anion nur begrenzt oder gar nicht freigesetzt; der Superabsorber kann nicht aktiviert werden.
Die Salzlösung des Urins ist etwa 0,9%ig. Sie entspricht der physiologischen Kochsalzlösung. Aus diesem
Grunde ist auch die Wirkung der Babywindeln begrenzt.
Wer sein Kind salzarm ernährt, kann also Windeln sparen.
Damit sind wir zurück zur Ausgangslage: Wenn Baby seine Göttespeise verputzt hat, reicht es die darin enthaltenen großen Wassermengen an den Superabsorber weiter.
Rüdiger Blume
Literatur zur Vertiefung:
H.-D. Belitz, W. Grosch und P. Schieberle: Lehrbuch der Lebensmittelchemie. Springer Verlag, Berlin
(neueste Auflage).
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 10. Juni 2010, Dagmar Wiechoczek