 |
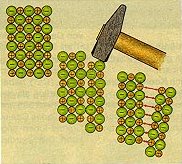
| Bild 1: Warum ein Ionenkristall spröde ist
(Quelle: Cornelsen) |
Ionengitter
Experimente:
Versuch: Züchten von Impfkristallen
Versuch: Kochsalzkristalle im Eiltempo
Versuch: Vergleich verschiedener Festkörper
Wenn du zu Hause den Küchenschrank öffnest, findest du das "Paradebeispiel"
für Ionenkristalle, das Kochsalz. Diese kannst du selber züchten (->
Versuch). Ionenkristalle werden aber nicht nur von Salzen gebildet.
Hierzu gehören auch Metalloxide wie das Magnesiumoxid sowie Metallhydroxide. Auf Fotos
kannst du z. B. nicht unterscheiden, ob es sich um Kochsalz- oder Magnesiumoxidkristalle handelt.
Die ionische Bindung
Das Gitter eines Ionenkristalls besteht aus positiv und negativ geladenen Ionen, die
sich bei der Gitterbildung zusammenlagern. (Das kann sehr schnell gehen; ->
Versuch.) Als ganzes ist der Ionenkristall nach außen hin
elektrisch neutral.
Aufgrund des Aufbaus aus elektrisch geladenen Teilchen leiten diese Stoffe als
Schmelzen oder wässrige Lösungen den elektrischen Strom.
Im Kristallgitter werden die Ionen durch elektrostatische Wechselwirkungen
(Coulombschen Bindungskräfte) zusammengehalten.
Die Coulombschen Bindungskräfte sind ungerichtet, aber sehr effektiv. Deshalb haben
Salze im Vergleich zu den Molekülgittern im Allgemeinen einen hohen Schmelzpunkt,
so Natriumchlorid bei 801 °C (-> Versuch).
Der Aufbau des Ionengitters erklärt auch, warum Salzkristalle (verglichen mit
Metallkristallen) so ausgesprochen spröde sind: Gleiten beim plötzlichen Deformieren
gleichgeladene Schichten aneinander vorbei, so stoßen sie sich in ihrer Gesamtheit
ab; der Kristall bricht.
 |
| Bild 1: Warum ein Ionenkristall spröde ist
(Quelle: Cornelsen) |
Länger anhaltender, starker Druck jedoch kann sehr wohl zur Deformation führen.
Dann verhalten sich Salze regelrecht plastisch.
Die Anordnung der Ionen im Gitter
Die Ionen ordnen sich bei ihrer Zusammenlagerung so an, dass sie anschließend eine
minimale potentielle Energie besitzen. Das wird durch zwei Beobachtungen gestützt:
| 1. | Es wird der Kontakt zwischen gleichgeladenen Ionen vermieden, da dadurch das Gitter instabil wird. |
| 2. | Um ein Ion werden so viele entgegengesetzt geladene Ionen gepackt, wie irgendwie möglich ist. Wenn sich wie beim Lithiumchlorid die Anionen berühren, so sinkt (verglichen mit anderen Chloriden) der Schmelzpunkt. So beträgt der Schmelzpunkt von NaCl 801 °C, von LiCl 614 °C. |
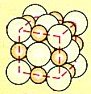 |
| Bild 2: Ionengitter von Kochsalz
(Quelle: Cornelsen) |
Je nach der relativen Größe von am jeweiligen Salz beteiligten Kationen und Anionen
gibt es unterschiedliche Gittertypen. Da, wie beim Natriumchlorid-Gitter deutlich zu sehen ist,
die Kationen im Allgemeinen kleiner sind als die Anionen, sind Salzkristallgitter häufig dichtest
gepackte Anionen-Gitter, deren Oktaeder- bzw. Tetraederlücken von den Kationen besetzt sind.
1 Kubische Gittertypen
Am einfachsten ist das kubische Gitter mit dem Habitus eines Würfels, das
Steinsalz-Gitter. Man erkennt die
würfelförmige Elementarzelle, die aus 8 Ionen besteht, darunter 4 kleine
Natrium-Ionen und 4 große Chlorid-Ionen. Jedes Ion ist oktaedrisch
von 6 Gegen-Ionen umgeben. Man sagt: Die Kationen befinden sich in den Oktaederlücken des
Anionengitters (und umgekehrt!). Das zeigt das folgende Bild: Hier sind in einem größeren Ausschnitt
des Kochsalzgitters diese Oktaeder eingezeichnet.
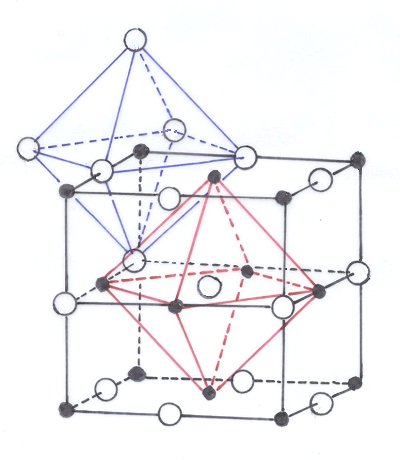
Bild 3: Gitter des Kochsalzes
(Grafik: Blume)
Dieser Gittertyp findet sich bei den meisten Alkalihalogeniden, ferner auch bei
Silberchlorid, Bleiglanz und Magnesiumoxid.
2 Weitere Gittertypen
Neben den kubischen Gittertypen gibt es bei den Ionengittern natürlich auch alle
anderen Kristallsysteme. Bekanntere Beispiele kannst du dieser Tabelle entnehmen:
| Kochsalz | kubisch |
| Beryll | hexagonal |
| Kaliumdihydrogenphosphat | tetragonal |
| Kalkspat | trigonal |
| Seignettesalz | rhombisch |
| Rotes Blutlaugensalz | monoklin |
| Kupfer(II)-sulfat-Pentahydrat | triklin |
Einige Ionenkristalle enthalten in stöchiometrischen Verhältnissen Kristallwasser. Dessen Moleküle besetzen fest definierte Gitterplätze. Man nennt diese Verbindungen Salzhydrate. Ein Beispiel ist das Kupfer(II)-sulfat-Pentahydrat.
Weitere Texte zum Thema „Kristalle“