 |
| Bild 1: Andenkengefäß eines Bergwerks mit den dort
vorkommenden Salzarten
(Foto: Daggi) |
 |
| Bild 1: Andenkengefäß eines Bergwerks mit den dort
vorkommenden Salzarten
(Foto: Daggi) |
Anmerkungen zum Thema "Salz" [1]
Experimente:
Versuch: Kochsalzkristalle im Eiltempo
Versuch: Löslichkeit und Korngröße
Versuch: Löslichkeit und Temperatur
Versuch: Lösungswärme, Volumenveränderung und
Siedepunktserhöhung
Versuch: Demonstration von temperaturabhängigen
Flüssigkristall-Effekten
Versuch: Ohne Rühren lösen Stoffe sich nur langsam
Versuch: Löslichkeit und Korngröße
Versuch: Abkühlung beim Lösen von Salzen
Versuch: Salze lösen sich in warmem Wasser schneller
Versuch: Auch Schwerlösliches löst sich in Wasser
Versuch: Wenn man Salz löst, wird das Wasser schwerer
Versuch: Kristallzüchtung
Versuch: Kältemischung aus Eis und Kochsalz
Versuch: Mit Salz bekämpft man Eis
Versuch: Salzwasser ist elektrisch leitend
Die meisten Menschen, die im Chemieunterricht nicht aufgepasst haben, stellen sich unter Salz nur eines vor: Kochsalz. Alle kennen es
aus der Küche, nennen seinen Geschmack "salzig", und so ist es seit langem und
wird wohl auch so bleiben. Salz ist und war nie aus der Menschheitsgeschichte wegzudenken. Viele
Orts-, Landschafts- und Flussnamen in Deutschland hängen direkt oder indirekt mit
Begriffen um das Salz zusammen. Das sind Namen, die auf Salz (vom indogermanischen Sel, Sal,
Bodensatz), Sole (althochdeutsch: Salzlösung, Suhle) oder Hals
(griechisch, keltisch: Salz) zurückzuführen sind: Salzburg, Salzach,
Salzkammergut, Bad Salzungen, Suhl, Sulzbach, Solingen, Saale, Salfeld, Saar, Hallstadt,
Halle in Sachsen-Anhalt und in Westfalen, Reichenhall, Hellen
(usw.). Ein Blick in das Register eines Atlanten überrascht. In Österreich gibt es sogar
einen Ort namens Solbad Hall - irgendwie klingt das doppeltgemoppelt.
Das sächsisch-anhaltinische Halle war ein berühmter Salzmittelpunkt mit Handelsbeziehungen nach fast ganz Europa. Zeigt das doch, welche Bedeutung das Salz, seine Gewinnung und der Handel damit für die Menschheit hatten. Und die Bedeutung ist nicht geringer geworden! Allerdings haben sich die Schwerpunkte stark verschoben.
Früher kannte man nur die natürliche, also physiologische Bedeutung des Salzes, zu
der auch die Lebensmittelkonservierung gehörte. Niemand hätte im Entferntesten daran
gedacht, Salz z. B. zum Abtauen von Glatteis vor der Haustür zu verschwenden. Es war in
manchen Gegenden so kostbar wie Gold!
Heute ist noch die Bedeutung der Salze für die Technische Chemie und für die
Alltagschemie hinzugekommen, die den Rahmen der natürlichen Bedeutung zu sprengen scheint.
Das hat u. a. auch seinen Grund in der Überproduktion dieses einmal kostbaren
Wirtschaftsguts, das damit zu einem teilweise unverkäuflichen Massenartikel verkommen ist.
Und mehr denn je stehen Kochsalz, seine Gewinnung und Verarbeitung im Verdacht,
umweltschädigend zu sein.
Zunächst aber: Was sind Salze?
Jeder Chemielehrer kennt die Schwierigkeit bei der Einführung des Salzbegriffs: Da ist die
Diskrepanz zwischen dem Salzbegriff aus der häuslichen Umgebung und dem aus dem chemischen Labor.
Sie ist nur noch zu vergleichen mit den Schwierigkeiten um den Stoff-Begriff im
Anfangsunterricht der Chemie.
Salze sind für Schüler "salzig, rieselig, ungiftig, würfelförmig
kristallin, farblos, gut löslich...". Und dann die Erkenntnis: Einige Salze schmecken
seifig (Soda), andere sauer wie Lakritz (Ammoniumchlorid), andere süß (Bleiacetat oder
Mangan(II)-sulfat), bitter (Magnesiumsulfat) oder sind ohne Geschmack. Viele Salze sind farbig,
die Löslichkeit schwankt zwischen leicht bis schwerlöslich, und man beobachtet
Kristalle aus allen Kristallsystemen.
Salz ist also viel mehr als nur Kochsalz: Chemiker nennen alle ionisch aufgebauten, festen
Verbindungen Salze. Man kennt von diesen "zusammengesetzten Körpern"
nahezu unbegrenzt viele, was sich schlicht aus der Möglichkeit von Kombinationen von
negativen und positiv geladenen Ionen ergibt.
Die Vielfalt dieser Stoffklasse ist erstaunlich. Man kann aber versuchen, sie zumindest in
Gruppen einzuteilen. (Das gibt Diskussionsstoff für einen lebendigen Chemieunterricht!)
Da gibt es Salze, deren Kationen Metall-Ionen sind und deren Anionen nur Nichtmetallatome
enthalten: Natriumchlorid NaCl, Pyrit FeS2 oder Kalkstein CaCO3. Es gibt
aber auch Salze mit Metallatomen in ihren Anionen: Kaliumchromat Na2CrO4
und Kaliumpermanganat KMnO4. Andere Salze enthalten überhaupt keine Metallatome:
Ammoniumchlorid NH4Cl oder Ammoniumacetat CH3COONH4. Dazu kommen
noch Salze, die in ihren Kristallen stöchiometrische Wassermengen eingelagert haben, die
Hydrate: Glaubersalz Na2SO4 · 10 H2O oder Bittersalz
MgSO4 · 7 H2O. Dann gibt es noch Komplexsalze wie das Silber-diammin-nitrat
[Ag(NH3)2]NO3. Und wenn man noch die Salze der organischen
Verbindungen einbezieht, wird es völlig unübersichtlich...
Man kann die Salze auch nach ihrer Wechselwirkung mit dem Lösemittel Wasser einteilen.
Viele Salze verändern nicht das Milieu ihrer Umgebung, wenn sie gelöst werden. Das sind
die Neutral- oder Inert-Salze, mit denen man Ionenkonzentrationen
("Ionenstärken") in der Elektrochemie oder Biochemie steuert. Beispiele sind
Chloride, Sulfate und Nitrate der Alkalimetalle.
Andere Salze reagieren mit Wasser im Sinne einer Säure/Base-Reaktion. Das sind saure
Salze wie Kaliumhydrogensulfat KHSO4 oder basische Salze wie Natriumcarbonat
Na2CO3.
Zu den Salzen gehören streng genommen auch die Metalloxide (wie auch die entsprechenden
Sulfide, Carbide und Nitride). So kann man auf Bildern
nicht unterscheiden, ob es sich um Kristalle von Natriumchlorid oder von Magnesiumoxid handelt:
Beide gehören dem kubischen Kristallsystem an und bilden schöne Würfel, beide
zeigen in der Schmelze elektrische Leitfähigkeit. Das ist Grundlage z. B. von
Schmelzelektrolysen zur Gewinnung von Metallen wie Aluminium aus ihren Oxiden. Gleiches
gilt auch für Metallhydroxide.
Wie entstehen Salze?
Salze bilden sich durch verschiedenste Reaktionen, die allesamt von großer Bedeutung
sind. Hier sind einige Beispiele:
NaOH (aq) + HCl (aq) ———> NaCl (aq) + H2O /exotherm
- Addition von Säureanhydriden an Basen:
Ca(OH)2 (aq) + CO2 (gasf.) ———> CaCO3 (fest) + H2O /exotherm
- Addition von Säureanhydriden an Metalloxide:
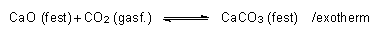
- Redoxreaktion zwischen Metall und Säure:
Fe (fest) + 2 HCl (aq) ———> FeCl2 (aq) + H2 (gasf.) /exotherm
- Redoxreaktion zwischen Metall und Nichtmetall:
2 Na (fest) + Cl2 (gasf.) ———> 2 NaCl (fest) /exotherm
- Austausch der Anionen:
AgNO3 (aq) + KCl (aq) ———> AgCl (fest) + KNO3 (aq) /exotherm
- Einwirkung von Säuren auf Metalloxide:
TiO2 (fest) + 2 H2SO4 (aq) ———> Ti(SO4)2 (aq) + 2 H2O /exotherm
- Brönstedsche Säure/Base-Reaktion ohne Wasserbeteiligung:
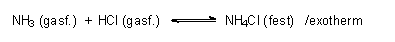
Reaktionen wie die Neutralisation, bei denen Lösungen der Salze entstehen, erfordern zur eigentlichen Salzbildung eine abschließende Kristallisation.
 |
| Bild 2: Selbstgezüchtete Salzkristalle
(Foto: Daggi) |
Wie Salze aufgebaut sind: Die ionische Bindung
Salze bestehen aus positiv und negativ geladenen Ionen. Deshalb leiten ihre Schmelzen und
wässrigen Lösungen den elektrischen Strom.
Im Kristallgitter werden die Ionen durch elektrostatische Wechselwirkungen (Coulombsche
Bindungskräfte) zusammengehalten. Die Ionen ordnen sich so an, dass sie
anschließend eine minimale potentielle Energie besitzen. Das führt zu dem hohen
Ordnungszustand, den wir beim Aufbau der Salzkristalle so bewundern.
Je nach der relativen Größe von am jeweiligen Salz beteiligten Kationen und
Anionen gibt es unterschiedliche Gittertypen. Man sollte es in der Schule aber beim einfachsten
und zugleich schönsten Typ belassen: Anhand des kubischen Kochsalzgitters lassen sich
räumliches Vorstellungsvermögen und Symmetrie-Empfinden am besten trainieren.
Die Coulombschen Bindungskräfte sind ungerichtet, aber sehr effektiv. Deshalb haben
Salze im Vergleich zu den Molekülgittern im Allgemeinen einen hohen Schmelzpunkt, so
Natriumchlorid bei 801 °C.
Der Aufbau des Ionengitters erklärt auch, warum Salzkristalle (verglichen mit
Metallkristallen) so ausgesprochen spröde sind: Gleiten beim plötzlichen Deformieren
gleichgeladene Schichten aneinander vorbei, so stoßen sie sich in ihrer Gesamtheit ab; der
Kristall bricht. Länger anhaltender, starker Druck jedoch kann sehr wohl zur Deformation
führen.
Der Streit um die Ionen
Die Hypothese, dass Salze aus Ionen bestehen, die beim Kontakt mit Wasser in
Lösung gehen oder sich beim Schmelzen voneinander lösen, geht auf Arbeiten von
Arrhenius in den Jahren 1884-1887 zurück. Er führte auch den Ionenbegriff ein und
sprach erstmals von "elektrolytischer Dissoziation". Seine Hypothese hatte heftige
Kontroversen zur Folge, wobei die Kritiker schlicht übersahen, dass bei der Dissoziation
nicht Atome von Natrium und Chlor entstehen, sondern eben deren inerte Ionen.
Lange Zeit noch sträubten sich die alten Professoren ("Ordinarien") gegen die neuen Erkenntnisse.
So gab es unter Studenten damals den Spruch:
|
"Willst du die Prüfung gut bestehen,
sprich nicht von Ionen aus Versehen!" |
Es gab allerdings noch lange Zeit Streit darüber, ob die Ionen schon vor dem Lösen oder Schmelzen der Kristalle im Gitter vorliegen, oder ob sie sich erst beim Lösen oder Schmelzen der Salze aus deren Molekülen bilden.
Sind alle Salze leicht löslich?
Salze gelten bei vielen Schülern von vornherein als leicht lösliche Stoffe. Das
stimmt für die Chloride und Nitrate der Alkali- und Erdalkalimetalle sowie für
Ammoniumverbindungen. Deshalb gelangen sie leicht ins Grundwasser und machen es für die
Nutzung als Trinkwasser unbrauchbar.
Glücklicherweise gibt es vor allem schwerlösliche Salze. Bei einigen könnte man bei
oberflächlichem Hinsehen sogar meinen, dass sie sich gar nicht lösen. Hierzu
gehören die Gesteins- und Bodenbildner wie Silicate und Erdalkalimetall-Carbonate. Aber
die Wirkung von Wasser und Eis über Jahrtausende hinweg beweist, dass sich auch harte
Gesteine wie Granit, die ja auch Salze sind, lösen: "Steter Tropfen höhlt den
Stein."
Andere schwerlösliche Salze wie die Sulfide der Schwermetalle sowie Bleichlorid und
-sulfat häufen sich in Ufersedimenten oder in Organen wie Niere, Knochensubstanz oder
Zähnen an (Summationsgifte).
Anhand der Löslichkeit von Salzen lässt sich
exemplarisch das chemische Gleichgewicht einführen
Wenn wir ein schwerlösliches Salz wie etwa Kalkstein in Wasser geben, bleibt im Allgemeinen
ein Bodensatz zurück, den wir auch durch gutes Schütteln und Rühren nicht auflösen können. Solch
eine Lösung mit Bodensatz bezeichnen wir als gesättigte Lösung. Der Grund für die Sättigung ist,
dass schwerlösliche Salze nur zum Teil dissoziieren.
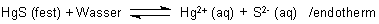
Es liegt ein chemisches Gleichgewicht vor. Die Gleichgewichtskonstante nennt man Löslichkeitsprodukt L. Es ist das Produkt aus den Konzentrationen der beteiligten Ionen; beispielsweise gilt für das Quecksilbersulfid:
LHgS = [Hg2+] · [S2-] (mol/l)2
Das Löslichkeitsprodukt ist ein Maß für die Löslichkeit eines Salzes. Je kleiner es ist, desto schwerer löslich ist der Stoff. So beträgt das Löslichkeitsprodukt des extrem schwerlöslichen Quecksilbersulfids HgS nur 10-54 (mol/l)2, das vom ebenfalls als sehr schwerlöslich geltenden Bleisulfat PbSO4 dagegen nur 10-8 (mol/l)2.
Es ist aber falsch anzunehmen, dass in dieser Lösung nichts mehr passiert! Könnten wir zuschauen,
so würden wir an der Oberfläche des Festkörpers ein ständiges Kommen und Gehen von Ionen beobachten.
Dabei löst sich genau so viel Salz wie sich wieder zurückbildet. Man sagt, dass hier ein
dynamisches chemisches Gleichgewicht vorliegt.
Dieses Gleichgewicht und damit der Wert von L
hängen besonders von der Temperatur ab. Erhitzt man eine Salzlösung mit Bodensatz, also eine
gesättigte Lösung, so löst sich das feste Salz mehr oder weniger auf. Kühlt man die so erhaltene
Lösung wieder ab, so entsteht eine übersättigte Lösung; der Bodensatz bildet sich wieder zurück.
(Hier erkennt man die Prinzipien von Le Chatelier wieder.) Lässt man besonders langsam abkühlen,
oder lässt man eine Lösung, die nicht gesättigt ist, langsam eindunsten, erhält man schöne
Salzkristalle. So werden Salzkristalle nicht nur gezüchtet, sondern so entstehen sie auch beim
Eindunsten der Meere.
Die Schwerlöslichkeit von Salzen wirkt sich auf die Umwelt
aus
Schwermetall-Ionen trennt man aus Abwässern grob durch Fällung als schwer
lösliche Salze ab. Dazu muss man Lösungs-Gleichgewichte einkalkulieren. Da der
Wert des Löslichkeitsprodukts konstant ist und nur von Temperatur und Druck abhängt,
kann man durch Erhöhung der Konzentration der einen Komponente die der anderen verringern.
Als Beispiel wählen wir das Bleisulfat:
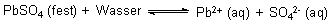
LpbSO4 = 10-8 (mol/l)2
LpbSO4 = [Pb2+] · [SO42-] = 10-4 mol/l · 10-4 mol/l
Es gilt eine ganz einfache Regel: Erhöht man [SO42-] auf 1 mol/l, also 100 mol/l, erniedrigt sich [Pb2+] auf 10-8 mol/l. Oder: Erhöht man die Konzentration der Sulfat-Ionen auf das Tausendfache, so verringert sich die Konzentration der Blei-Ionen um genau eben diesen Faktor. Dieses ist auch eine Anwendung von Le Chateliers Prinzipien.
Die Menge an gelöstem Salz wird häufig unterschätzt, vor allem auch dann, wenn das Löslichkeitsprodukt scheinbar sehr klein ist und wenn dazu noch mehr als zwei Ionen am Lösungsgleichgewicht beteiligt sind. Ein Beispiel ist das schwerlösliche Bleichlorid mit L = 1,6 · 10-5 (mol/l)3 (20 °C).
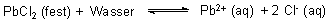
Wie viel Gramm von diesem Salz lösen sich in einem Liter Wasser?
L = cPb · cCl · cCl
Mit cCl = 2 cPb folgt
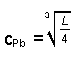
cPb = 1,59 · 10-2 mol/l
cCl = 3,18 · 10-2 mol/l
ßPb = cPb · MPb = 3,294 g/l
ßCl = cCl · MCl = 1,129 g/l
ßPbCl2 = 4,42 g/l
Die Trinkwasser-VO schreibt für Blei den Grenzwert 40 µg/l vor. Eine bei Zimmertemperatur gesättigte Lösung von schwerlöslichem Bleichlorid ist mit ihrem Bleigehalt von 3,294 g/l um den Faktor 8 · 104 konzentrierter, als der Grenzwert zulässt, und ist entsprechend toxisch.
Ohne schwerlösliche Salze könnte man nicht bauen
Grundlage unserer Bauindustrie ist der Kalkstein, chemisch Calciumcarbonat CaCO3.
Dieser wird gebrannt, wobei Kohlenstoffdioxid entweicht. Das resultierende Calciumoxid
(ebenfalls ein Salz) wird mit Wasser vermischt. Dabei entsteht Calciumhydroxid Ca(OH)2.
Mit diesem Mörtel wird gemauert. Er nimmt beim Aushärten wieder Kohlenstoffdioxid aus der Luft
auf und bildet so Steine verbindenden Kalkstein zurück.
Kalkstein hat sich über viele Jahrmillionen hinweg aus Meeres- und Flusssedimenten gebildet.
Noch heute können wir zusehen, wie das geschieht: In Meeren bildet er sich aus den Schalen von
Muscheln und anderen Tieren. Nicht zu vergessen sind die Korallen, die zusätzlich auch Dolomit
bilden. Aber auch Algen scheiden im Verlauf der Fotosynthese riesige Mengen an Kalk ab. Die
Algen benötigen Kohlenstoffdioxid zur Fotosynthese, das sie zusammen mit Wasser in Glucose und
Sauerstoff umwandeln.
6 CO2 + 6 H2O ———> C6H12O6 + 6 O2
In Fluss- oder Meereswasser liegen vor allem Calcium-Ionen und Hydrogencarbonat-Ionen vor. Entnehmen die Algen dem Wasser CO2, so bildet sich Kalkstein. Denn sie verschieben das folgende Gleichgewicht nach rechts:
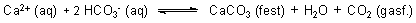
Dieser segensreiche Mechanismus sorgt nicht nur für Kalkbildung, sondern auch für eine ausgewogene CO2-Bilanz unserer Atmosphäre - bei gleichzeitiger Sauerstoffbildung!
Wie entstehen Salzlager?
Die großen Salzlager entstanden ausnahmslos durch Eindunsten von Binnenmeeren oder von
Lagunen, die vom Meer abgeschnitten waren. Das beobachten wir heute noch in Nordamerika,
Nordafrika oder am Toten Meer. Entsprechend der Löslichkeit der verschiedenen Salze bilden
sich charakteristische Schichtungen der Sedimente aus. Zunächst fällt der am
schlechtesten lösliche Gips aus. Darüber legt sich das relativ schwerlösliche
Natriumchlorid; es folgen Kaliumchlorid und dann Mischsalze von Magnesium und Kalium.
Darüber lagern sich die leichtlöslichen Magnesiumsalze ab.
Nicht unerwähnt bleiben sollen die durch Sedimentierung gebildeten ungeheuren Mengen an schwerlöslichen Carbonaten von Calcium und Magnesium. Außerdem entstanden und entstehen aus Gesteinsschmelzen Silicate, die die Hauptmenge der Salze auf der Erde ausmachen.
Salz ist unter hohem Druck plastisch: Wie Salzstöcke
entstehen
Jeder, der im Labor schon mit Infrarot-Geräten gearbeitet hat, weiß, dass man
aus Kaliumbromid unter Einsatz von hohem Druck Gläser pressen kann, die für
IR-Strahlung durchlässig sind. Dieses plastische Verhalten beobachten wir auch bei
natürlichen Salzlagern.
Aus den zunächst waagerechten Meeresablagerungen bilden sich in vielen Millionen Jahren
unter seitlichem Druck benachbarter Erdschichten propfenartige, hohe Salzstöcke
("Salzdome"), die sogar an die Erdoberfläche gelangen können.
In letzter Zeit sind die ausgebeuteten Salzdome in die öffentliche Diskussion geraten:
Statt sie mit Abraum aufzufüllen, sollen sie als Endlager für ausgebrannte
Kernbrennstoffe dienen. Das hat gewisse Vor- und leider auch gravierende Nachteile. Positiv
ist, dass Risse, die möglicherweise auftreten können, durch die Plastizität
des Salzes wieder verschlossen werden. Andererseits kann so ein Lager seine Last durch
fortwährende Aufpressung nach oben transportieren, also regelrecht wieder
"ausspucken". Dadurch besteht die Möglichkeit, dass der radioaktive
Müll in einigen Hunderttausend Jahren wieder an die Erdoberfläche gelangt. Das
ist bei Halbwertszeiten wie 24 400 Jahre beim Plutonium-239 keine schöne Aussicht für
die Zukunft.
Über den Aufpressungen bilden sich aber auch Erdöl- und Erdgas-Lagerstätten aus, die man ebenfalls gern ausbeutet, und die umgekehrt wieder als Depots für Erdgas und Erdöl genutzt werden können.
Wie man Salze gewinnt
Die hutartigen Aufpressungen der Salzstöcke sind hervorragend geeignet, um
bergmännisch Salze zu gewinnen. Das führte aber aufgrund ihrer durch die Genese
bedingten Schichtungen zu riesigen Abraumhalden. Einen nicht geringen Teil davon entsorgte
man in die umgebenden Gewässer und Flüsse ("Aus den Augen, aus dem Sinn!").
In den Siebziger Jahren betrug der Salzgehalt der Weser aufgrund der Salzeinträge in die
Werra bis zu 8 %, also mehr als doppelt so viel wie der von Meerwasser. Meerestiere wie Krebse
tauchten auf, salzliebende Pflanzen (Halophyten) machten sich am Ufer breit. Ähnlich erging
es dem Rhein bei der Passage durch lothringische Salzfelder. Erst internationale Abkommen und
politischer Paradigmen-Wechsel haben hier geholfen.
Wie war es früher? Schon in der Keltenzeit wurde im Salzkammergut in der Gegend von
Hallstatt Salz bergmännisch gewonnen. Das war aber nicht überall möglich.
Salz liegt in der Natur am leichtesten zugänglich als Lösung vor. Schon früh
hat man deshalb Verfahren entwickelt, um daraus Salz zu isolieren.
Das ist einfach an warmen Meeresküsten, wo man nur künstliche Lagunen
("Salzgärten") anlegen und abwarten muss, bis die Sonne das Wasser
verdunstet. Das Meersalz enthält immerhin um die 60 % Alkalihalogenide. Den zuerst
ausfallenden Gips beseitigt man durch Vorkristallisation. Dann trennt man die sich nun bildenden
Natriumchloridkristalle ab, bevor Kalisalze sowie anschließend die besonders störenden,
weil bitteren und dazu noch hygroskopischen Magnesiumsalze ausfallen. Letzte Reinigung erfolgt
durch Umkristallisation.
Vor allem in Australien spielen die Salzgärten eine große Rolle, in einem
Kontinent, der fast keine Salzstöcke aufweist. Das hat seinen Grund in der (mit Mitteleuropa
verglichen) geringen geologischen Aktivität des Kontinents.
Besonders gut hatten es früher die Römer: Sie konnten das Tote Meer mit
dessen sagenhaften Gehalt an 230 g Natriumchlorid/l ausbeuten. (Ab 300 g/l ist Wasser praktisch
gesättigt.) Ihr Ausdruck salarium für Salzgeld ist in unserer Sprache als "
Salär" bekannt. Auf dem Export von Salz beruhte auch der Reichtum der Phönizier,
die im heutigen Libanon siedelten.
In Deutschland kannte man den Salzgehalt der in der Landschaft verbreiteten, von Tieren zur
Körperpflege genutzten "Suhlen", die auf dem Austreten von salzhaltigen Quellen
beruhten. Ein Beispiel unter Tausenden ist die Region um Halle in Sachsen. Die
Salzlösungen wurden filtriert und in großen Salzpfannen eingedampft. (Eine
sehr schöne Beschreibung dieser Verfahren enthält das alte Buch von Hoffmann [2].)
Dieses Salzsieden hatte einen großen Bedarf an Brennmaterial zur Folge. Steinkohle
und Braunkohle gab es kaum. So griff man auf Holz zurück. Allein der Salzbedarf der Hanse
in Lüneburg, die ihren Reichtum auf Fang und Einpökeln von Heringen sowie auf deren
Verkauf im christlichen und dadurch durch Speisevorschriften gegängelten Abendland
begründete, führte zum Ausrotten der großen Buchenwälder der Norddeutschen
Tiefebene und zur Entstehung der unfruchtbaren Lüneburger Heide!
Warum sind Salze für den Menschen so wichtig?
Bleiben wir vor allem beim Kochsalz. Noch heute reicht man in vielen Gegenden der Welt
Gästen zur Begrüßung Brot und Salz. Das gehört auch zu den drei
Grundkomponenten unseres Brots.
Im Körper sind davon rund 170 g enthalten. Das Bewusstsein für seine
Lebensnotwendigkeit ist sicherlich genetisch fixiert. Das erinnert letztlich daran, dass
die Evolution auch des höheren Lebens im Meer begann!
Es gibt verschiedene Gründe für den Wert des Salzes.
| - | Kochsalz ist physiologisch hochwirksam. So regelt es den osmotischen Druck von Blut und Harn. Eine 0,9%ige Kochsalzlösung ist Lösemittel für Medikamente, die gespritzt werden müssen. Weiter liefert NaCl Chlorid-Ionen für die Salzsäurebildung im Magen. Chlorid-Ionen sind auch wichtig für die physiologische Bildung von Hydrogencarbonat-Ionen und regeln somit den zellulären Ausstoß von CO2. Natrium-Ionen sind zusammen mit Kalium-Ionen für die Funktion der Nerven wichtig. Salzig ist einer der (seit 1999 fünf) Geschmacksempfindungen. Deshalb sind die Ionen des Kochsalzes auch wichtige Geschmackverstärker. |
| - | In der Lebensmitteltechnologie dient Salz zur Konservierung von empfindlichen Speisen wie Fisch, Fleisch und Milchprodukten. Hier ist das schon erwähnte Einpökeln zu erwähnen. Die Wirkung beruht auf osmotischer Austrocknung von Mikroorganismen. |
| - | Technisch dient Kochsalz zur Herstellung von Natrium-Metall, Chlor, Natronlauge und dem Koppelprodukt Wasserstoff. Dabei bedient man sich der Elektrolyse. Das dabei entstehende Chlor war zunächst Abfallprodukt, spielt heute aber eine wichtige Rolle als Industriechemikalie, die weit über die eines Bestandteils von Polyvinylchlorid (PVC) hinausgeht. Mit Chlor werden vor allem in der Organischen Chemie Übergangsverbindungen bei Substitutions-Reaktionen hergestellt. Seine Rolle wird wegen der Bildung von Dioxinen, die bei vielen (vor allem auch unfallbedingten) Reaktionen möglich ist, in teilweise unschöner Form kontrovers diskutiert ("Chlorfreie Chemie?"). |
Aus Kochsalz gewinnt man weiter mit Hilfe des Solvay-Verfahrens die wichtige
Industriechemikalie Soda, Natriumcarbonat. Was wären die Glasherstellung oder
die Waschmittelindustrie ohne Soda?
Salzschmelzen dienen in großem Umfang zum Abdecken von Metallschmelzen. Das
spielt z. B. beim Recyceln von Aluminium eine wichtige Rolle. Das heiße Metall wird so
vor dem Angriff durch Sauerstoff geschützt. Zusätzlich werden bereits vorhandene
oxidische Überzüge, die das Zusammenschmelzen erschweren, abgeätzt.
Bemerkenswert ist, dass Salze auch negative Auswirkungen auf Metalle haben. Sie sind
nämlich hervorragende Korrosionsförderer.
Viele Elemente liegen als Salze bzw. Oxide und Sulfide vor und lassen sich daraus gewinnen
(Mineralien, Erze). Das gilt gleichermaßen für Metalle wie Nichtmetalle.
Und abgesehen vom Holz sind auch die klassischen Baumaterialien letztlich Salze!
Salze im Alltag: Mischungseffekte in Salzlösungen und
Salzschmelzen
An Salzlösungen und -schmelzen lassen sich einfach, aber exemplarisch Einblicke in die
Physikalische Chemie gewinnen. Dabei kommt es gar nicht so sehr auf quantitative Aussagen an,
sondern nur auf das qualitative Verständnis der Zusammenhänge.
Löst man ein Salz in Wasser oder in einer Schmelze, so treten aufgrund der Wechselwirkungen zwischen dem Lösemittel und dem gelösten Stoff bestimmte, auch für die Umwelt wichtige Effekte auf.
Siedepunktserhöhung (Dampfdruckerniedrigung)
Salzwasser siedet bei höherer Temperatur als reines Wasser. Der Grund: Die gelösten
Stoffe halten die Wassermoleküle in der Lösung fest. Daher muss mehr Energie als
normal zugeführt werden, um diese Bindungen zu lösen. Das Lösemittel verdampft
deshalb erst bei höheren Temperaturen.
Schmelzpunktserniedrigung (Gefrierpunktserniedrigung)
Man beobachtet, dass verunreinigte feste Stoffe einen niedrigeren Schmelzpunkt haben als
die Reinstoffe. Der Grund ist, dass die Verunreinigungen die hohe Ordnung des Kristallgitters
des Reinstoffs stören, und dieses deshalb schon bei niedrigerer Temperatur zusammenbricht.
Das ist in der Technik wichtig. Bei der Schmelzelektrolyse von Natriumchlorid senkt man dessen
Schmelzpunkt von 801 °C mit Calciumchlorid und Bariumchlorid auf ca. 600 °C. Das spart Energie bei
der Elektrolyse, senkt also die Aktivierungsenergie und verringert den
"Wärmemüll".
Das gilt aber auch für das Auskristallisieren des Lösemittels Wasser aus
salzhaltigen Lösungen, was in den folgenden Abschnitten verdeutlicht wird.
Salziges Meerwasser bleibt auch unter Null Grad flüssig
Salzwasser kann man weit unter 0 °C, dem Gefrierpunkt von reinem Wasser, abkühlen. Der
Grund: Eis, das aus Salzwasser auskristallisiert, ist reines Wasser. Die von den Ionen des
gelösten Salzes festgehaltenen Wassermoleküle werden gehindert, ein Eiskristallgitter
aufzubauen. Dies gelingt erst bei tieferen Temperaturen, da die dann freiwerdende
größere Kristallisationsenergie ausreicht, die Lösemittelmoleküle aus ihrer
Bindung an Ionen und andere Stoffe zu lösen. Salziges Meerwasser gefriert deshalb nicht so
rasch.
Kältemischungen
Beim Mischen von Kochsalz mit Eis stellen sich definierte, tiefe Gleichgewichtstemperaturen
ein. Grund ist, dass die Lösungswärme für das Salz und die Schmelzwärme
für das Eis aus dem System oder aus der näheren Umgebung entnommen werden. Vermischt
man z. B. 33 g Kochsalz innig mit 100 g feinverteiltem Eis, so erreicht man Temperaturen von
-21,3 °C. (Man spricht hier von einem eutektischen Gemisch.) Mit 133 g
Calciumchlorid-Hexahydrat, vermischt mit 100 g Eis, soll man sogar -55 °C erreichen!
Mit Salz kann man Glatteis bekämpfen
Den Effekt der Gefrierpunktserniedrigung nutzt man im Winter, um Glatteis zu schmelzen.
Hierzu werden möglichst umweltneutrale Salze (NaCl oder CaCl2-Hydrate) auf das
Eis gestreut. Dabei beobachtet man, dass sich festes, scheinbar trockenes Eis
verflüssigt. Eis steht in einem dynamischen Gleichgewicht mit flüssigem Wasser:
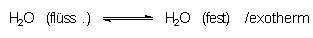
Deshalb ist Eis immer mit einem feinen Flüssigkeitsfilm überzogen.
Gibt man nun Salz hinzu, so beginnt sich dieses unter gleichzeitiger Abkühlung im
Wasserfilm aufzulösen. Das dem Gleichgewicht entzogene Wasser wird aus dem Eis ständig
nachgebildet. Das Gleichgewicht verschiebt sich somit in die linke Richtung; das Eis
verflüssigt sich zu einer konzentrierten Salzlösung. Da das NaCl/Eis-Gemisch keine
tieferen Temperaturen als -21,3 °C ermöglicht, nützt unterhalb dieser Temperatur das
Streuen von Natriumchlorid nichts mehr. Eine Alternative ist das umweltneutralere Calciumchlorid
CaCl2, ein Abfallprodukt der Sodaherstellung nach Leblanc, da dessen
konzentrierte Lösungen erst ab -55 °C gefrieren.
Osmotischer Druck
Hierbei handelt es sich um die Wechselwirkung an einer semipermeablen Membran zwischen
reinem Wasser und einer konzentrierten Lösung, z. B. von Kochsalz. Der
Konzentrationsausgleich hat eine Verdünnung sowie einen hydrostatischen Druck zur Folge.
Dieser ist proportional zur Gesamtkonzentration der Ionen.
Lässt man umgekehrt einen hohen Druck auf diese Anordnung einwirken, so gibt die
Salzlösung das Reinwasser zurück. Solche Anlagen nutzt man zur Meerwasser-Entsalzung;
das Verfahren heißt Umkehr-Osmose.
Der Salzgehalt im Meer hat Auswirkungen auf das Klima
Dass der Salzgehalt der Meere wichtige Auswirkungen auf das Klima hat, überrascht
viele Menschen. Fassen wir die Fakten noch einmal zusammen:
Meerwasser ist aufgrund der gelösten Salze (durchschnittlicher Gehalt 3,6 g/l)
spezifisch schwerer als Reinwasser. Je mehr Salz gelöst ist, desto schwerer ist das Wasser.
Das Salzwasser strömt vom Äquator, wo es aufgrund der Wärmeausdehnung eine
geringe Dichte und deshalb einen höheren Pegel hat, nach Norden (und natürlich auch
nach Süden). Dabei kühlt es ab. Da es aus wärmeren Regionen stammt, ist seine
Salzkonzentration höher als die im Polarmeer. Als schwereres Wasser sinkt es deshalb im
Polarbereich ab und hält so die klimabestimmende Nord-Strömung im Atlantik aufrecht.
Meerwasser gefriert erst bei einigen Grad unter Null (Gefrierpunktserniedrigung). Damit ist
Salzwasser auch bei niedrigeren Temperaturen flüssig. Geringere Eisbildung hat wiederum
Auswirkungen auf die Absorption von Sonnenstrahlung.
Außerdem verdunstet Meerwasser nicht so leicht, da die Ionen die Wassermoleküle
nicht so einfach freigeben (Siedepunktserhöhung). Über salzreichem Meerwasser ist
deswegen der Wasserdampfgehalt der Atmosphäre niedriger als über Süßwasser.
Das ist wichtig für Wetterbildung über dem Meer: Über dem Meer bilden sich nicht
so viele Wolken und es regnet auch nicht so stark, wie man allgemein erwartet. Außerdem
speichert trockene Luft nicht so viel Wärme wie eine feuchte Atmosphäre.
Salz hilft gegen Schnupfen
Bei beginnendem Schnupfen und auch, wenn er einen schon befallen hat, hilft 0,9%iges Salzwasser,
das man sich in die Nase "schnauft" oder tropft. Selbst die Chefärzte von HNO-Kliniken
schwören darauf. Man sollte die Lösung vorm Einschnaufen etwas anwärmen.
Ohne Salz kein Leben
Lassen wir zum Schluss Friedrich Hoffmann aus Halle zu Worte kommen. In
seinem Werk von 1708 schreibt er erstaunlich modern, was Salz auch heute noch für uns
bedeutet:
Unter den dreyen Reichen/darein die Natur-Kündiger die Cörper eingetheilet/ ist der
Mensch die edelste Creatur und gleichsam der König der Thiere; unter den Pflantzen der
Weinstock; unter den Mineralien hat man davor gehalten/ dass es das Gold sey. Allein
wenn man die Sache gar genau untersuchet und einsiehet/ so findet sich zwar wol/ dass das
Gold an und vor sich selbsten das edelste Metall/ und wegen seiner rarität sehr hoch
zu achten/ und also zu Commercien das bequemste sey. Wenn man aber dessen Krafft/ Nutzen
und Wirckung betrachtet/ so ist dieselbe/ was des menschlichen Cörpers Erhaltung und
Gesundheit betrifft/ gar keine oder sehr geringe. Denn alle diejenigen/ welche so ein Miracul aus
dem Golde machen in Stärckung der Natur/ und zu Erlangung der Gesundheit/ verstehen des
Goldes und menschlichen Cörpers Wesen und Natur gar nicht. Meines Erachtens aber/ so halte
ich unter denen Mineralien vor allen das edelste Geschöpff/ das gemeine Saltz/ weil
es unter allen unterirdischen Cörpern den meisten Nutzen schaffet/ der zur Erhaltung/ Leben/
Gesundheit der Menschen und Viehe/ auch Daurung anderer verderblichen Dinge sehr groß ist. [2]
Nun gut, es fehlt der Hinweis auf die technische Bedeutung des Salzes. Die spielte zu Hoffmanns Zeiten sowieso keinerlei Rolle. Aber im Notfall könnten wir gut auf die Ergebnisse dieser Techniken verzichten, jedoch niemals auf ausreichende Versorgung unseres Körpers mit Salz!
Literatur
[1] Dieser Artikel erschien in gekürzter Fassung:
E. Rossa (Hrsg.): Die Fundgrube für den Chemieunterricht; Cornelsen Scriptor, Berlin 2001.
[2] Friedrich Hoffmanns Kurtze doch gründliche Beschreibung des Saltz-Wercks in Halle; in
Verlegung des Waysen-Hauses, Halle MDCCVII. (Als Reprint herausgegeben von der Gesellschaft für
Umwelt- und Wirtschaftsgeologie mbH Berlin, Invalidenstraße 44, Berlin 1990.)
Weitere Texte zum Thema „Kristalle“