 |
| Bild 1: Kristallwasserhaltige Salze: Gips (1), Alaun (2),
Kupfersulfat (3)
(Foto: Daggi) |
Die Struktur von Salzhydraten: Was ist Kristallwasser?
Experimente:
Versuch: Nachweis von Kristallwasser
Versuch: Der besondere Einzelkristall: Chromalaun
Versuchsgruppe: Wärmekissen
 |
| Bild 1: Kristallwasserhaltige Salze: Gips (1), Alaun (2),
Kupfersulfat (3)
(Foto: Daggi) |
Kristalle mancher Verbindungen enthalten Wasser, das beim Erhitzen entweicht (->
Versuch). Dabei verändert sich die Struktur des Kristalls.
Dieses Wasser nennt man "Kristallwasser". Die Kristalle enthalten das Wasser in exakt
stöchiometrischen Verhältnissen. Die Dipole der Wassermoleküle liegen im Gitter außerdem
räumlich exakt ausgerichtet vor. Das zeigt schon, wie die Moleküle gebunden sind: Es
handelt sich um Ion-Dipol-Wechselwirkungen oder um Wasserstoffbrückenbindungen. Schon
hier sei gesagt: Der Übergang zu Komplexverbindungen
ist fließend.
Einige wichtige Beispiele aus deinem Schullabor zeigt die folgende Tabelle.
| Chemische Bezeichnung | Formel | Gebräuchlicher Name |
| Kupfer(II)-sulfat-Pentahydrat | CuSO4 · 5 H2O | Kupfervitriol |
| Natriumsulfat-Decahydrat | Na2SO4 · 10 H2O | Glaubersalz |
| Natriumacetat-Trihydrat | Na(CH3COO) · 3 H2O | Natriumacetat(trihydrat) |
| Magnesiumsulfat-Heptahydrat | MgSO4 · 7 H2O | Bittersalz |
| Magnesiumchlorid-Hexahydrat | MgCl2 · 6 H2O | Bischofit |
| Natriumcarbonat-Decahydrat | Na2CO3 · 10 H2O | Soda |
| Calciumsulfat-Dihydrat | CaSO4 · 2 H2O | Gips |
| Cobalt(II)-chlorid-Hexahydrat | CoCl2 · 6 H2O | - |
| Kalium-Aluminium-sulfat-Dodecahydrat | KAl(SO4)2 · 12 H2O | Alaun |
| Eisen(II)-sulfat-Heptahydrat | FeSO4 · 7 H2O | Grünsalz |
| Kalium-Natrium-tartrat-Dihydrat | KNa(C4O6H4) · 2 H2O | Seignettesalz |
| Citronensäure-Monohydrat | C3H4OH(COOH)3 · H2O | Citronensäure |
| Glucose-Monohydrat | C6H12O6 · H2O | Traubenzucker |
Bemerkenswert ist, dass es nicht nur kristalline Hydrate von Salzen gibt. Auch die Citronensäure ist ein Monohydrat, das rhombische Kristalle bildet. Auch die Glucose liegt im Allgemeinen als rhombisch kristallisierendes Monohydrat vor.
Wie sind die Wassermoleküle im Kristallgitter gebunden?
Die Wassermoleküle befinden sich im Kristallgitter an geometrisch genau definierten
Stellen. Sie sind also Gitterbausteine.
Im Natriumcarbonat-Decahydrat sind sie keinen Ionen zugeordnet, erleichtern offenbar
nur den Gitteraufbau und sorgen für dessen Stabilität.
Im Magnesiumchlorid-Hexahydrat sind 6 Wassermoleküle oktaedrisch um ein
Magnesium-Ion angeordnet. Sie sind durch Ion-Dipol-Kräfte gebunden. Das Gitter besteht also
aus Wasser-Magnesium-Oktaedern und ähnlich großen Chlorid-Ionen. Man spricht hier
von Kationenwasser.
Beim Magnesiumsulfat-Heptahydrat tritt noch ein siebtes Wassermolekül pro
Formeleinheit hinzu. Dies ist als Anionenwasser am Sulfat-Ion
fixiert.
Beim Kupfer(II)-sulfat-Pentahydrat finden wir ebenfalls Kationen- wie Anionenwasser
im Kristall. Nur sind die Wassermoleküle viel fester an Kupfer-Ionen als an Magnesium-Ionen gebunden; wir
sprechen hier von Aquakomplexen. Die Fixierung ähnelt
kovalenten Bindungen. Das 5. Wassermolekül besetzt eine Gitterstelle zwischen dem Komplex
und dem Sulfat-Ion. Kupfer(II)-sulfat-Pentahydrat müssen wir chemisch exakt deshalb wie folgt
schreiben:
[Cu(H2O)4]SO4 · H2O
Wie sich Salzhydrate bilden
Die Bildung von Salzhydraten darf nicht mit der Hydratation
(Solvatation) von Ionen in wässriger Lösung verwechselt werden!
Grundsätzlich werden alle normalen Ionenkristalle aus nicht hydratisierten Ionen, also freien
Kationen (wie Na+) und Anionen (wie Cl- oder Acetat-), aufgebaut.
Bei der Kristallisation eines in Wasser gelösten Salzes (egal ob Natriumchlorid oder Natriumacetat)
muss deshalb zur Bildung des Ionengitters zuallererst die Hydrathülle, also die Wasserhülle der in
der Lösung vorliegenden hydratisierten Ionen abgestreift werden. Der Gitteraufbau kann beginnen;
Kristalle entstehen.
Das gilt auch für die Gitter der Salzhydrate. Bei ihnen kommt während des Abkühlvorgangs noch etwas hinzu: In den Zwischenräumen der Gitter nehmen zunächst verstreut herum vagabundierende Wassermoleküle präzise festgelegte Plätze ein, wobei sie auch noch ihre Dipole nach einem exakt vorgegebenen Schema ausrichten müssen. Außerdem ist auch die Anzahl der Wassermoleküle pro Formeleinheit genau definiert. So sind das zum Beispiel drei Wassermoleküle auf ein Natriumacetat-"Molekül".
Wie kann Kristallwasser entfernt werden?
Viele Hydrate zeigen das Phänomen, dass sie an trockner Luft ihr Kristallwasser
abgeben. Sie "verwittern". Auch der Chromalaun KCr(SO4)2
· 12 H2O zeigt dieses Phänomen. Sein Analoges, der Aluminiumalaun
KAl(SO4)2 · 12 H2O, ist dagegen stabil. Deshalb
kann man den schönen Chromalaun mit einer dünnen Schicht von Aluminiumalaun stabilisieren
(-> Versuch). Der Grund für das unterschiedliche Verhalten ist, dass
die Wassermoleküle in den Aquakomplexen von Chrom(III) weniger fest gebunden sind als in denen von
Aluminium.
 |
 |
| Bild 1a: Chromalaun;
Links: frische Kristalle, rechts: verwitterte Kristalle, dazwischen liegen 14 Tage (Fotos: Daggi) |
Das Verwittern beobachtest du auch beim Kupfersulfat, das dabei weiß wird.
Diesen Vorgang kannst du aber auch beschleunigen, indem du das Salzhydrat erhitzt. Gehst du
dabei vorsichtig vor, so bildet sich wasserfreies, weißes Kupfersulfat.
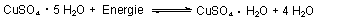
Die Abgabe erfolgt stufenweise. (Das kann man anhand der Thermoanalyse feststellen.) Außerdem ist der Vorgang reversibel. Deshalb lässt sich mit weißem Kupfersulfat Wasser nachweisen.
Besser gelingt das allerdings mit Cobaltchlorid (-> Versuch). Dies ist im wasserfreien Zustand blau gefärbt, mit Kristallwasser dagegen rot. Du kennst die Verbindung vielleicht als Feuchtigkeitsindikator beim Blaugel. Das ist ein hygroskopisches Kieselgel, das als Trocknungsmittel für elektronische Geräte dient. Man stellt es auch gern in Infrarot-Spektralfotometer. Deren Optik besteht nämlich aus feuchtigkeitsempfindlichen Salzen (NaCl-Prismen).

|
| Bild 2: Blaugel - ohne und mit Kristallwasser
(Foto: Daggi) |
Erhitzt du blaues Kupfer(II)-sulfat-Pentahydrat zu stark, wird das Kristallwasser zusammen mit
dem Schwefeltrioxid abgegeben. Das ist die Grundlage der historischen Verfahren zur
Schwefelsäureherstellung durch Vitriol-Destillation.
Zurück bleibt schwarzes Kupfer(II)-oxid.
Aber auch bei anderen Salzen führt zu starkes Erhitzen zu irreversiblen Kristallveränderungen. Beim Gips dürfen z. B. nur drei Viertel des Wassers abgespalten werden.
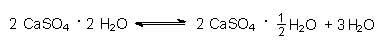
Nur dann entsteht gebrannter Gips, den man beim Bauen verwenden kann. Entfernt man alles Wasser, reagiert der Gips nicht mehr, er ist "totgebrannt".
Die Hydratbildungsenergie ist technisch wichtig
Bei Zugabe von Wasser zu wasserfreien, hydratbildenden Salzen erhitzt sich die Mischung
stark (-> Versuch). Die Wärme, die bei der Hydratbildung
frei wird, nennt man Hydratbildungswärme. Dabei handelt es sich
um eine latente Wärme, die z. B. bei den
Latentwärmespeichern (Wärmekissen) technisch genutzt wird.
(In den "Wärmekissen" ist das entsprechende Salz Natriumacetat-Trihydrat enthalten.)
Das Verwittern von Hydraten stört bei der Laborarbeit
Diese chemische Veränderung von Kristallen hat aber auch zur Folge, dass es oftmals schwer ist,
exakt konzentrierte ("eingestellte") Lösungen dieser Stoffe herzustellen. Das wird z. B. bei der
Citronensäure deutlich: Beim Titrieren einer genau abgewogenen Portion dieser Säure beobachtet man
fast immer, dass bis zum Äquivalenzpunkt mehr Natronlauge zugegeben werden muss als zuvor berechnet
wurde. Grund: Da die Säure beim längeren Stehen in der Sammlung Hydratwasser verloren hat, also
verwittert ist, wiegt man einfach zuviel Citronensäure ein. Der Verbrauch an Natronlauge ist
deshalb zu hoch.
Umgekehrt kann man durch Titration natürlich auch den Verwitterungsgrad der Citronensäure ermitteln.
Auch bei der Glucose dampft das Kristallwasser relativ leicht ab. Deshalb ist es auch hier
schwierig, exakte Einwaagen zu erhalten.
Weitere Texte zum Thema „Kristalle“