Prof. Blumes Tipp des Monats September 1999 (Tipp-Nr. 27)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Bunte Chemie: Elektrolyse von Ammoniumchloridlösungen
Ihr habt sicherlich schon einmal die Elektrolyse von Natriumchloridlösungen durchgeführt. Warum untersucht ihr nicht mal das Elektrolyseverhalten von wässrigen Ammoniumchloridlösungen? Dabei könnt ihr wieder einmal eine Menge Chemie lernen.
An der Anode entsteht Chlor:
2 Cl- ———> Cl2 + 2 e-
Das Chlor reagiert mit Iodid zu Iod: Cl2 + 2 I- ———>
2 Cl- + I2, das mit Stärke den bekannten blauen Komplex bildet.
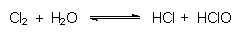
Außerdem reagiert Chlor mit Wasser zu Säuren, daher die Reaktion des feuchten
Indikatorpapiers.
An der Kathode entsteht Wasserstoff:
2 H+ + 2 e- ———> H2
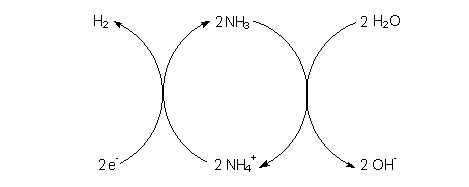
Woher aber stammen die entladenen Protonen? An der Kathode weist ihr zusätzlich Ammoniak nach. Es entsteht aus den Ammonium-Ionen. Diese liefern gleichzeitig die Protonen. Deshalb müsst ihr den Kathodenvorgang etwas genauer formulieren:
2 NH4+ + 2 e- ———> 2 NH3 + H2
Das Ammoniak reagiert wieder mit Wasser zu Ammonium-Ionen, wobei sich Hydroxid-Ionen
bilden.
Vergleicht diesen Mechanismus mit der Elektrolyse von Natriumchloridlösungen, bei der
sich ja auch Hydroxid-Ionen bilden. Diese entstammen aber direkt dem Wasser, dessen Protonen
entladen werden.
Ihr seht, dass das System Ammoniak/Ammonium-Ionen als Katalysator wirkt. Das
Reaktionsgeschehen können wir deshalb als Katalyse-Kreisprozess formulieren.
Allerdings wird das Ammoniak zunehmend ausgetrieben, da die Lösung immer basischer wird.
Wenn wir die Elektrolyse von vornherein in Gegenwart eines pH-Indikators durchführen, können wir direkt verfolgen, was in den Elektrodenräumen passiert.
|
Versuch 2: Elektrolyse von mit pH-Indikator versetzten Ammoniumchloridlösungen Geht vor wie in Versuch 1. Setzt der Ammoniumchloridlösung zuvor ausreichend Lösung von Bromthymolblau (w = 0,1 % in Ethanol; F) zu. Die Mischung sollte nun kräftig gelblichgrün gefärbt sein. Sofort nach Beginn der Elektrolyse beobachtet ihr an der Kathodenoberfläche blaue Schlieren. An der Anode hellt sich der Farbstoff kräftig auf. Hier wird er zum Teil durch das Chlor zerstört. Probiert auch andere Indikatoren aus!
Bild 2: Ammoniumchlorid vor und nach der Elektrolyse
|
Es gibt auch Indikatoren, die die Redoxlage der Elektrolytlösungen in den
Elektrodenräumen anzeigen. Damit könnt ihr ebenfalls bunte Lösungen zaubern.
Ein solcher Redoxindikator ist das Ferroin.
Dessen Lösung könnt ihr direkt bei Merck kaufen.
|
Versuch 3: Elektrolyse von Ammoniumchloridlösungen in
Gegenwart von Ferroin
Bild 3:Ammoniumchlorid vor und nach der Elektrolyse
|
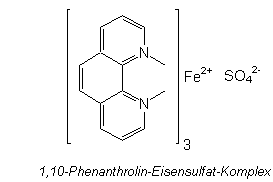
Ferroin ist übrigens der Indikator, der auch bei der Belousov-Zhabotinskii-Reaktion
(auch bekannt als "oszillierende Reaktion") eingesetzt wird. Chemisch handelt es sich um einen
1,10-Phenanthrolin-Eisensulfat-Komplex. Mit zweiwertigem Eisen sind seine Lösungen rot
gefärbt, mit dreiwertigem Eisen blau. Letztere entstehen, wenn starke Oxidationsmittel wie
das Chlor anwesend sind.
Diese Versuche könnt ihr natürlich auch mit Natriumchloridlösungen durchführen. Allerdings riecht ihr dann kein Ammoniak, und das Metall Natrium könnt ihr auch nicht sehen, da es sich aufgrund zu hoher Überspannung aus wässrigen Lösungen gar nicht abscheiden lässt.
In der Chemiegeschichte spielt übrigens die Suche nach dem "NH4-Metall" eine große Rolle. Es bildet sich tatsächlich bei der Elektrolyse von Ammoniumchloridlösungen mit Quecksilber-Elektroden.
NH4+ + e- ———> NH4
Das NH4 ist ein Radikalmolekül. Es ist jedoch nur als Amalgam bekannt und in wässrigen Lösungen weder herzustellen noch stabil. Es existiert nur bei tiefen Temperaturen in flüssigem Ammoniak als Lösemittel.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek


