Der pKa-Wert und der Umschlagsbereich von Phenolphthalein
Experimente:
Versuch: Fotometrische Titrationen von Indikatoren
Bei der Besprechung der Reaktionen des Phenolphthaleins
haben wir gehört, dass die Reaktionen dieser Substanz auf einem System von schwachen Säuren und Basen
beruhen. Kann man vielleicht mindestens einen pKa-Wert ermitteln, zum Beispiel den, der
Aufschluss über den Umschlagsbereich (Farblos -> Purpurfarbig) des Indikators gibt?
Eine direkte Titration mit einem pH-Meter, wie wir es bei der Essigsäure kennengelernt haben, ist nicht möglich, weil sich Phenolphthalein in Wasser kaum löst.
Dennoch lesen wir: Der pKa-Wert von Phenolphthalein liegt bei pH 9,5. Woher weiß man das?
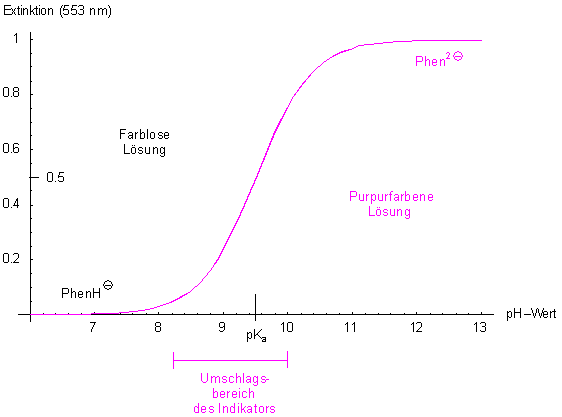
Dazu muss man das pH-abhängige Spektrum und die fotometrische Titrationskurve des Indikators aufnehmen. Bei dieser Methode misst man die Änderung der Absorption von Licht (Messgröße Extinktion, lat. extenuo, schwächen) in Abhängigkeit vom pH-Wert. Dass man auch bei großen Verdünnungen arbeiten kann, ist nur möglich, weil der Absorptionskoeffizient von Phenolphthalein in alkalischem Milieu mit 105 bis 105 (l mol-1 cm-1) sehr hoch ist, so dass auch bei geringsten Konzentrationen das Mess-Signal des Fotometers ausreicht.
Da der Farbstoff purpurrot ist, absorbiert er aus dem eingestrahlten Weiß grünes Licht (Komplementärfarbe). Die Wellenlänge seines Absorptionsmaximums liegt bei lmax = 553 nm.

Berechnete fotometrische Titrationskurve von Phenolphthalein
Die Messung ist allerdings nicht ganz einfach, da sich im stark alkalischen pH-Bereich das farblose
Carbinol bildet und die Extinktion langsam abnimmt. Es muss deshalb oberhalb von pH 12 sehr rasch gearbeitet
werden. Man kann sich aber auch getrennte Pufferlösungen vorbereiten und jeweils zur Messung die gleiche
Menge an Farbstofflösung hinzu pipettieren. Aus diesem Grunde gibt es eine gewisse Unsicherheit hinsichtlich des
pKa-Werts, und man findet in verschiedenen Büchern Werte zwischen 9,0 und 9,5.
Weil um 553 nm nur die Bildung des Di-Anions beobachtet wird, entspricht diese Titrationskurve der Dissoziationskurve einer schwachen einbasigen Säure. Im Prinzip erfassen wir fotometrisch nur das folgende Reaktionssystem.
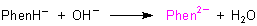
Um auch die anderen Gleichgewichte des Phenolphthaleins zu untersuchen,
benötigen wir Messungen im UV-Bereich des Spektrums. Diese sind aber für den Einsatz als Indikator nicht wichtig.
Noch ein Hinweis: Zur Berechnung der Titrationskurve haben wir die maximale Extinktion der Lösung im Zustand des Di-Anions formal gleich 1 gesetzt. (Auf dieser Webseite erklären wir die Rechnung.)
Weitere Texte zum Phenolphthalein