Autokatalysen sind nicht nur für die Entstehung von Leben wichtig
Experimente:
Versuch: Autokatalyse bei der Permanganat/Oxalsäure-Oxidation
Versuch: Autokatalyse beim Zersetzen von Kupfer in Salpetersäure
Versuch: Organischer Entwickler als Reduktionsmittel für Silberhalogenide
Versuch: Oszillierende Reaktion der Malonsäure mit Iodat und Mangan
Versuch: Wachstum einer Pflanze
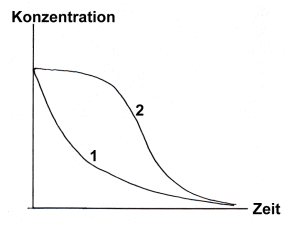
Bei vielen Reaktionen wird der Katalysator erst während der Reaktion gebildet. Das
hat eine Beschleunigung der Reaktion zur Folge. Es erinnert an das Wachstum von
Lebewesen. Hier sind einige Beispiele, die sich leicht nachvollziehen lassen.
1 Redoxtitrationen mit Kaliumpermanganat
Oxidiert man Oxalsäure mit Kaliumpermanganat, so sollte sich die Lösung
entfärben:
Ox: COOH-COOH ———> 2 CO2 + 2 e- + 2 H+ · 5
Red: MnO4- + 8 H+ + 5 e- ———> Mn2+ + 4 H2O · 2
Redox: 5 COOH-COOH + 2 MnO4- + 6 H+ ———> 10 CO2 + 2 Mn2+ + 8 H2O
Zunächst scheint gar nichts zu geschehen (-> Versuch). Dann beginnt die Reaktion langsam einzusetzen, was man an der beginnenden Entfärbung der Lösung erkennt. Die Entfärbung geht zum Schluss immer schneller vonstatten. Grund ist, dass Mangan(II)-Ionen die Reaktion katalysieren. Da diese sich während der Reaktion bilden, nimmt die Konzentration des Katalysators im Verlaufe der Reaktion zu.

Bild 1: Zeitlicher Ablauf einer katalysierten Reaktion (1) und einer Autokatalysereaktion (2)
Die Rolle der Mangan(II)-Ionen kann man leicht zeigen, indem man sie wie in
unserem Versuch geschehen von vornherein zur Reaktionsmischung zugibt.
2 Kupfer und Salpetersäure
Wenn man Kupfer in konzentrierte Salpetersäure gibt, setzt nur langsam eine Reaktion ein (->
Versuch). Das Kupfer überzieht sich dabei mit einem farblosen
Gas (NO), das wegen der Oxidation an der Luft braun wird (NO2). Die Reaktion wird immer
schneller. Das ist das Bild einer typischen Autokatalyse. Katalysatoren sind die während
der Reaktion gebildeten Stickoxide.
3 Cu + 2 HNO3 + 6 H+ ———> 3 Cu2+ + 2 NO + 4 H2O
3 Zersetzung des Minerals Markasit
Markasit ist die instabile Vorstufe von Pyrit, FeS2. Es zersetzt sich in Gegenwart
von Sauerstoff und Wasser unter Bildung von Eisen(II,III)-sulfat und Schwefelsäure.
FeS2 + 3½ O2 + H2O ———> FeSO4 + H2SO4
Da Säuren den Prozess katalysieren, liegt auch hier eine Autokatalyse vor. Das ist nicht nur für Steinesammler fatal, da ihnen dadurch die schönsten Sammlerstücke unaufhaltsam zerstört werden. Da Markasit typischer Begleiter von Kohle ist, werden auch die Kohlehalden langsam zur Quelle für Schwefelsäure mit den Folgen der Bodenversauerung. Mehr dazu lies in unserer Webseite zu Pyrit und Markasit nach.
4 Fotografische Entwicklung
Eine Autokatalyse beobachtet man auch bei der fotografischen Entwicklung.
Hier werden die belichteten Silberbromidkristalle zu Silber reduziert.
Sie enthalten nämlich Silberatome (Latentes Bild), die als
Katalysatoren wirken. Das gilt auch für die zusätzlich entstehenden Silberatome.
Reduktionsmittel ist zum Beispiel Hydrochinon, abgekürzt H2Q.
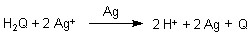
Wenn man ein belichtetes Bild in die Entwickler-Lösung legt, so sieht man zunächst nichts, dann aber erscheint das Bild immer schneller. Dies kann man auch schon durch Vergleich der Reaktionen mit unbelichtetem und belichtetem Silberhalogenid zeigen. Letzteres enthält aufgrund der Lichteinwirkung katalytisch wirksame Silberatome (-> Versuch).
5 Oszillierende Reaktionen
Autokatalysen spielen auch bei den oszillierenden chemischen Reaktionen
("Chemische Pendel") eine wichtige Rolle (-> Versuch). Sie sind
deshalb auch Modelle für biologische Systeme. Auch
für die Chaosforschung sind sie von Bedeutung.
6 Pflanzenwachstum
Wenn man beobachtet, wie eine Bohne keimt, wird einem die Bedeutung der
Autokatalyse für das Leben deutlich. Eine Bohne trägt die Ressourcen für ihr
Primärwachstum in sich. Dann schiebt sich ein weißer Keim vor, der im Licht grün
wird. Nun beginnt die Pflanze, selbständig zu arbeiten, indem sie ihre eigenen
Enzymsysteme, also Katalysatoren aufbaut. Sie entwickelt sich immer rascher, wird
größer... (-> Versuch).
Klick mich an!
Bild 2: Keimende Bucheckern
(Foto: Blume)
Weitere Texte zum Thema „Katalyse“