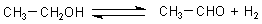
Katalysatoren machen Reaktionslenkung möglich
Experimente:
Versuch: Katalytische Dehydrierung von Ethanol
Versuch: Oxidation von Alkoholen und Ketonen an Kupferdraht
Versuch: Katalytische Dehydratisierung von Ethanol
Versuch: Katalytische Ethersynthese aus Ethanol
Man kann durch den Einsatz verschiedener Katalysatoren eine
Reaktion bezüglich der Geschwindigkeit steuern (-> Webseite).
Es ist aber auch möglich, durch Wahl eines Katalysators für ein gegebenes
Eduktgemisch die Reaktionsrichtung zu bestimmen. Man spricht von selektiver
Katalyse.
Dazu kommen als Steuerungsfaktoren natürlich noch Druck, Temperatur,
Konzentrationseffekte und ggf. Abziehen eines Produkts zur
Gleichgewichtsverschiebung.
Reaktionen von Ethanol
Ethanol kann ohne weitere Edukte je nach eingesetztem Katalysator drei wichtige
Reaktionen eingehen.
1a Dehydrierung
In Gegenwart von Kupfer oder Silber wird unter Sauerstoffabschluss bei 550 °C Wasserstoff
abgespalten; es entsteht Acetaldehyd (-> Versuch).
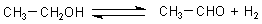
In der Gegenwart von Nickel und bei niedrigen Temperaturen sowie höherem Druck
liegt das Gleichgewicht auf der linken Seite.
(Im Allgemeinen gibt man noch Sauerstoff zu, um am Kontakt den Wasserstoff zu
verbrennen und so das Gleichgewicht nach rechts zu verschieben.)
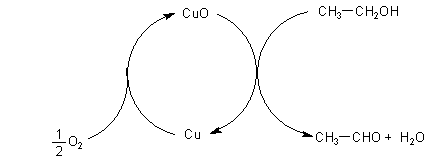
1b Oxidierende Dehydrierung
In Gegenwart von erhitztem Kupfer wird mit Sauerstoff neben Acetaldehyd Wasser gebildet
(-> Versuch).
CH3-CH2OH + ½ O2 ———> CH3-CHO + H2O
Hier läuft also eine "echte" Oxidation ab. Katalysator ist das Paar Kupfer/Kupfer(II)-oxid.
2a Dehydratisierung
Bei Kontakt von Ethanol mit Aluminiumoxid wird Wasser abgespalten; es entsteht
Ethen (-> Versuch).
CH3-CH2OH ———> CH2=CH2 + H2O
Als Katalysatoren können auch Schwefelsäure, Phosphorsäure oder Zinkchlorid dienen. Als Nebenreaktion läuft bei Verwendung von Schwefelsäure die Kondensation zu Diethyl-Ether ab.
2b Kondensation
Ethanol kann unter Einwirkung von konzentrierter Schwefelsäure also nicht nur
dehydratisiert werden, sondern auch unter Etherbildung reagieren (->
Versuch).
2 CH3-CH2OH ———> CH3-CH2O-CH2-CH3 + H2O
Um die Etherausbeute zu erhöhen, arbeitet man (anders als bei der Dehydratisierung) mit Ethanolüberschuss.
Beispiel Korrosion
Ein weiter Beispiel für Reaktionslenkung durch Katalyse ist die Korrosion. Hier kann man auch
das Prinzip der positiven und negativen Katalyse verdeutlichen. Das schildern wir auf einen besonderen
Webseite.
Weitere Texte zum Thema „Katalyse“