
Die Katalase-Reaktion
Experimente:
Versuch: H2O2-Zerfall und verschiedene Katalysatoren
Versuch: Eisenverbindungen zersetzen Wasserstoffperoxid
Versuch: Zwischenkomplexbildung bei der katalytischen Zersetzung
von Wasserstoffperoxid mit Eisen(III)-salzen
Versuch: Nachweis der Katalase in Kartoffeln
Es gibt viele Möglichkeiten, Wasserstoffperoxid katalytisch zu zersetzen (-> Versuch).
Die effektivste ist sicherlich die mit der Katalase, die in unserem Blut zu finden ist.

Blut zersetzt Wasserstoffperoxid
(Foto: Daggi)
Die Katalase ist ein relativ großes Enzym mit der Molmasse 2,4 · 105 g/mol. Es
enthält vier Hämgruppen. In diesen befindet sich das Eisen im Oxidationszustand +III.
Das hat bekanntlich die Koordinationszahl 6. Vier Bindungen zielen zu den N-Atomen
des Porphyrinrings des Häm, eine zu einem Aminosäurerest des Proteins und die
sechste Koordinationsstelle ist mit einem Wassermolekül besetzt.
Hauptaufgabe der Katalase ist die Zerstörung des Zellgifts Wasserstoffperoxid. Dieses stammt letztlich vor allem aus Sauerstoff, der bei der Endreaktion der Atmungskette statt vier nur ein Elektron erhalten hat. Das so gebildete, sehr toxische Superoxid-Ion O2- wird durch die Superoxid-Dismutase umgesetzt.
2 O2- + 2 H+ ———> H2O2 + O2
Der systematische Name der Katalase ist H2O2 : H2O2-Oxidoreduktase. Ihre Katalysewirkung betrifft die Redoxreaktion zwischen zwei H2O2-Molekülen, also eine Disproportionierung.
Redoxreaktion: H2O2 + H2O2 ———> 2 H2O + O2 /exotherm
In diesem Zusammenhang sei daran erinnert, dass H2O2 je nach Umgebung einmal als Oxidationsmittel und einmal als Reduktionsmittel wirken kann.
Es findet also ein Elektronenübergang zwischen zwei Molekülen statt, an dem die Katalase beteiligt ist.
Die Katalase ist überall in unserem Körper, besonders konzentriert aber in der Leber und in den roten Blutkörperchen zu finden. Umgekehrt kann man mit der Katalase-Reaktion auch den Nachweis für das Vorliegen des Enzyms führen (-> Versuch). So findet man die Katalase auch in Kartoffelschalen und in Bananen. Das ist nicht verwunderlich, denn die Superoxid-Ionen bedrohen alle aeroben Organismen.
Die Katalase ist eines der effektivsten Enzyme. Es hat einen
Q10-Wert von nahezu 1. Die Umsatzzahl ist entsprechend hoch:
5 · 106 Moleküle/min.
Hier wird jedes H2O2-Molekül, das durch Diffusion mit dem aktiven Zentrum in Kontakt
kommt, augenblicklich zerlegt. Wir sprechen in diesem Fall sogar von einem
"Ping-Pong-Mechanismus", also einem Mechanismus scheinbar ohne merkliche
Zwischenverbindung.
Dennoch muss natürlich eine Zwischenverbindung da sein. Das kann man mit Hilfe von
spektroskopischen Änderungen am Häm feststellen. Häm ist tiefrot gefärbt (Blutfarbe!)
und hat eine typische Absorptionsbande bei 405 nm. Diese verschiebt sich im Verlauf
der Reaktion. Außerdem verändern sich die magnetischen Eigenschaften des
Enzyms; das spricht für das Auftreten von ungepaarten Elektronen, also von
Radikalmolekülen.
Ohne Substrat liegt die Katalase komplexiert mit Wasser, also als Kat-Fe3+-OH2 vor.
Das Wassermolekül wird durch ein Wasserstoffperoxid-Molekül verdrängt. Denn H2O2
bildet Komplexe mit Übergangsmetallen wie Chrom oder Kupfer(II),
die allesamt H2O2 zu zersetzen vermögen. Das gilt ganz besonders auch für
Eisen-Verbindungen. Die sind schon lange bekannt dafür, dass sie katalytische Fähigkeiten
zur Zersetzung von Wasserstoffperoxid zeigen (-> Versuch).
Was im aktiven Zentrum der Katalase abläuft, weiß man noch nicht so richtig. Deshalb
schildern wir hier die Vorgänge bei der in vitro-Reaktion von Eisen-Ionen mit
Wasserstoffperoxid.
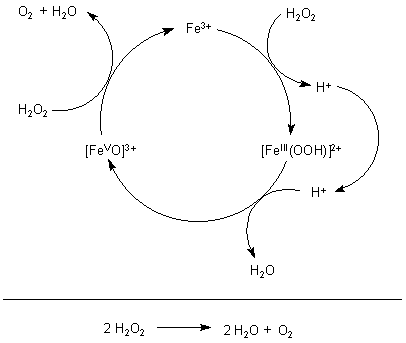
Katalysekreisprozess der Zersetzung von H2O2 durch Fe3+-Ionen
Bei Gegenwart von H2O2 bildet sich ein Sauerstoffkomplex des
Eisens, das intermediär in der Oxidationsstufe
+V vorliegt. Dieser reagiert unter Rückbildung von Fe3+ mit einem weiteren Molekül
H2O2 zu Sauerstoff und Wasser.
Es gibt noch weitere Mechanismen, unter anderem solche, bei denen ·OH-Radikale und HOO·-Radikale auftreten. Diese bilden radikalische Reaktionsketten und können somit die hohe Reaktionsgeschwindigkeit besser erklären.
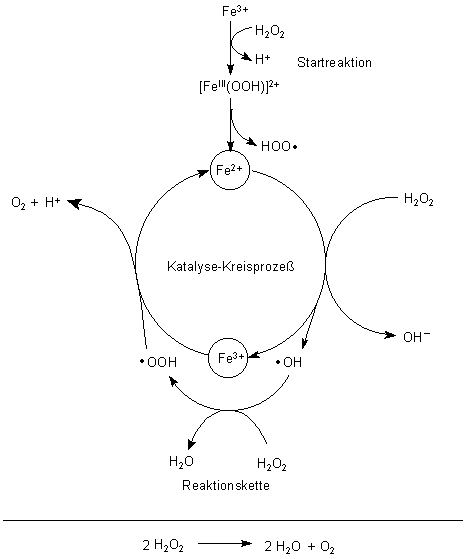
Redoxkettenreaktion der Zersetzung von H2O2 durch Fe3+-Ionen
Offenbar fördert der Einbau von Eisen-Ionen in den Porphyrinring und in das
Enzymprotein die katalytische Fähigkeit der Eisen-Ionen, denn die Wirkung von
Katalase ist viel stärker als die der Eisen-Ionen (-> Versuch). Es wird
auch diskutiert, ob nicht auch einzelne Aminosäurereste aus dem Protein oder sogar der Porphyrinring an der
Redoxreaktion beteiligt sind.
Zur Chemie mit Wasserstoffperoxid haben wir eine große
Webseitengruppe.
Weitere Texte zum Thema „Katalyse“