Der Mechanismus der katalysierten hydrolytischen Spaltung von Mehrfachzuckern
Experimenteliste zu den Kohlenhydraten
In der Schule werden gerne Polysaccharide wie die Cellulose und Disaccharide wie die Saccharose zum Verständnis ihrer Zusammensetzung chemisch gespalten. Dabei fragen uns immer wieder viele Lehrer und Schüler, wie das funktioniert, was da im Molekül abläuft, was der Reaktionsmechanismus ist.
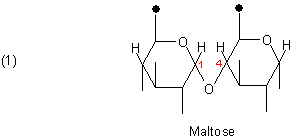
Als Beispiel wählen wir das Disaccharid Maltose.

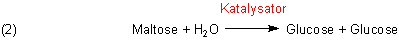
Zunächst einmal besprechen wir die Hydrolyse eines Mehrfachzuckers unter
Einwirkung einer Säure. Dabei handelt es sich um eine Protonenkatalyse.
Das etherartige O-Atom der Vollacetalbindung ist stark elektronenziehend; das
führt zu einer Polarisierung der Bindungsumgebung. Dabei ist das C-Atom 1 des
linken Rings stärker positiv polarisiert als das C-Atom 4 des rechtens Rings.
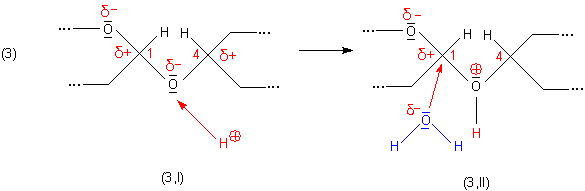
An das Vollacetal-O-Atom wird ein Säureproton addiert (3,I). Am besonders stark
positiv polarisierten C-Atom 1 des Carbkations koppelt gleichzeitig ein Wassermolekül
an (3,II). Die C-O-Bindung am C-Atom 1 öffnet sich. Unter Zurücklassung eines Oxoniumkations
spaltet das erste Monozuckermolekül ab (4,III).
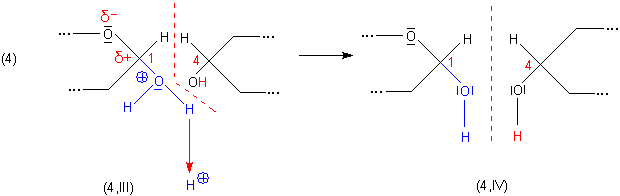
Mit dem Abgang des Protons wird anschließend auch das zweite Monozuckermolekül gebildet
(4,IV).
Das so zurück gewonnene Proton addiert sich an die nächste Acetalbindung (3,I); damit ist der Katalysekreisprozess geschlossen und beginnt erneut.
Schonender erfolgt die enzymatische Spaltung durch Glykosidasen. Es handelt sich um eine gekoppelte Säure/Base-Katalyse, bei der wahrscheinlich ein Imidazolrest der Aminosäure Histidin sowie ein Thiolrest der Aminosäure Cystein kooperieren.
Interessant sind die unterschiedlichen Aktivierungsenergien. Bei der Protonenkatalyse sind zur Hydrolyse der Saccharose 110 kJ/Mol aufzuwenden, zur enzymatischen Katalyse (wie im Fall der Saccharase = ß-Fructofuranosidase) dagegen nur 46 kJ/Mol.
Weitere Texte zum Thema „Kohlenhydrate“