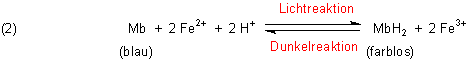
Modell für die Fotosynthese: Fotoreduktion von Methylenblau
Experimente:
Versuch: Fotoreduktion von Methylenblau
Die Fotosynthese beruht formal letztlich darauf, dass bei
Einstrahlung von sichtbarem Licht Elektronen von angeregten Substanzen auf Wasser übertragen werden.
Bei diesen komplexen Reaktionen entstehen neben Sauerstoff reduzierende Stoffe wie NADH, mit denen über ein kompliziertes Enzymsystem CO2 und Wasser zu Glucose umgesetzt werden.
(1) H2O + NADP+ + Lichtenergie ———> NADPH + H+ + ½ O2
Eine Modellreaktion für eine solche lichtabhängige Elektronenübertragung
ist die Photoreduktion von Methylenblau mit Eisen(ll)-Ionen.
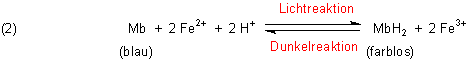
(Wir kürzen Methylenblau mit Mb ab. Die reduzierte Form (Leukomethylenblau; lat. leukos,
weiß) ist MbH2.)
Zur Erklärung:
Das Redoxsystem Eisen(II)/Eisen(III) hat ein stark positives, das System Mb/MbH2 ein weitaus
niedrigeres Redoxpotential:
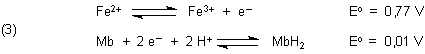
Wir entnehmen den Standardpotentialen (3): Eisen(II) ist hier Elektronendonor. Da es eine ausgeprägte Tendenz
hat, Eisen(III) zu bilden, ist sein Potential positiv. Methylenblau ist Elektronenakzeptor. Es hat ein Potential,
das dem von Wasserstoff entspricht.
Exergonisch, also dem natürlichen Energiegefälle folgend, könnten Elektronen eigentlich nur von Leukomethylenblau auf Eisen(III) übertragen werden. Die beobachtete Hin-Reaktion (2) sollte also gar nicht ablaufen können.
Absorbiert der Farbstoff Methylenblau jedoch Lichtenergie (was bekanntlich jeder farbige Stoff macht), so werden seine Moleküle derartig angeregt, dass sein Redoxpotential stark ins Positive verschoben wird und er auf diese Weise in der Lage ist, Eisen(II) zu Eisen(III) zu oxidieren.
Diese Reaktion ist aufgrund der energetischen Verhältnisse reversibel: Ohne Zufuhr von Lichtenergie, also im Dunkeln, färbt sich die Lösung deshalb wieder blau. Dann treten die „natürlichen“ Energiegefälle in den Vordergrund: Eisen(III) oxidiert farbloses MbH2 zurück zu blauem Mb.
Weitere Texte zum Thema „Kohlenhydrate“