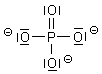
Phosphat-Ion
Einfache Modelle für die Komplexbindung
Der Chemiker Werner hat zwar die Zusammensetzung der Komplexeinheiten richtig gedeutet, aber was die Bindungen anbelangte, tappte er reichlich im Dunkeln. Man wusste, dass Komplexe Verbindungen höherer Ordnung waren, deren „Bindigkeit" nicht mit der „Wertigkeit" übereinstimmte. Seit Braggs Arbeiten war es jedoch möglich geworden, auch die Geometrie der Komplexeinheiten zu ermitteln. Dazu durchleuchtet man auch heute noch die durch die Arbeit vieler fleißiger Doktoranden hergestellten Komplexverbindungen mit Röntgenstrahlen und bekommt so Aufschluss über den Aufbau dieser Substanzen.
Zur Deutung der verschiedenen Komplexgeometrien, unterschiedlichen Bindungsarten, verschiedenen Farbigkeiten (die von Farblos bis zu auffälligen Pinkfarben reicht) wurden Bindungstheorien entwickelt. Die basierten vor allem auf den Erkenntnissen aus den unterschiedlichen magnetischen Eigenschaften der Komplexverbindungen.
Überlegen wir uns, wie Komplexbindungen zustande kommen. Zunächst sind Lücken in der Elektronenanordnung im Zentralteilchen (Lewissäure), die durch Elektronenpaare der Liganden (Lewisbase) aufgefüllt werden. Schon früh sprach man von dativer Bindung oder von koordinativer Bindung. Ersteres bedeutet „Bindung durch Gebung" und das zweite „Bindung durch Zusammenwirken".
Bei allen Theorien spielen Orbitalüberlappungen eine Rolle, die wir unter dem Begriff Orbital-Hybridisierung kennen. Hier sind vor allem die d-Orbitale einzukalkulieren. Sie betreffen nicht nur die so genannten Nebengruppen-Elemente. Sie sind auch bei einigen Hauptgruppenelementen „vorgeformt" und können besetzt werden, auch wenn sie noch gar nicht "aufgerufen" worden sind. (Dies ist bekanntlich normalerweise erst in der nächsten Periode der Fall, wenn sich nach dem 4s2-Erdalkalimetall die Nebengruppen-Metalle einschieben.) Das betrifft vor allem die Elemente der dritten Reihe im PSE.
Ist das nicht ein Widerspruch zur Oktettregel? So meinte man früher, dass man ruhigen Gewissens die Phosphorsäure mit zehnbindigem Zentralelement zeichnen könnte; denn es sollten bei diesem Bindungssystem auch 3d-Orbitale beteiligt sein.
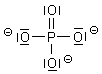
Phosphat-Ion
Heute wissen wir, dass das wegen der großen Energieunterschiede zwischen 3p und 3d nicht möglich ist. Diese Diskussion betrifft auch das analoge Sulfat-System.
Paulings Valence Bond-Theorie
Linus Pauling postulierte, dass eine Komplexbindung durch Überlappung eines
leeren Hybridorbitals des Zentralteilchens mit einem aufgefüllten Orbital eines
Liganden erfolgt. Die Bindung erfolgt unter Ausbildung eines s-Hybridorbitals.
1 Beispiel Hexa-aqua-aluminium-Komplex
Nehmen wir als Beispiel den Hexa-aqua-aluminium-Komplex. (Erinnern wir uns: Auch
bei einigen Hauptgruppenmetallen gibt es ja Komplexe!)
Al steht in der 3. Hauptgruppe und hat zwei Elektronen in der 3s- und eines in der 3p-Schale.
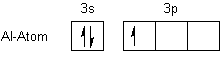
Im Komplex liegt es als Al3+-Ion vor. Es hat die stabile Edelgasschale des Neons.

Die sechs Wasser-Liganden gruppieren sich um das Aluminium-Ion, indem sie ihre nichtbindenden Elektronenpaare einbringen. Dazu benutzen sie auch die präformierten 3d-Orbitale mit.
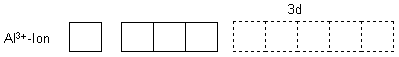
Dahinein passen nichtbindende Elektronenpaare der sechs Wassermoleküle.
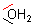
Zwar hat jedes Wassermolekül zwei nichtbindende Orbitale, von denen es aber nur eines zur Ausbildung der koordinativen Bindung nutzt.
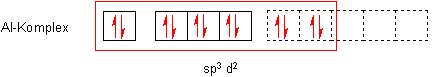
Wenn sich sechs Liganden mit geringster Abstoßung um ein Zentralteilchen gruppieren, bildet sich ein Oktaeder. Man kann auch sagen: Es bilden sich sechs gleichwertige sp3d2-Hybridorbitale.
2 Beispiel Tetrafluoroaluminat-Anion
Mit Fluorid-Ionen bilden Aluminium-Ionen den folgenden Komplex.
Warum haben wir hier nicht auch die Koordinationszahl 6 wie beim Aquakomplex?
Sehen wir uns den Aufbau nach Paulings Modell an.
Die Fluorid-Ionen haben vier nichtbindende Orbitale, von denen sie nur eines zur
Ausbildung der koordinativen Bindung nutzen.
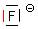
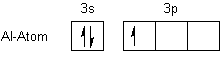

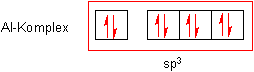
Wir haben im Komplex vier Orbitale, die vier gleichwertige sp3-Hybridorbitale bilden. Deren Anordnung hat bekanntlich Tetraederstruktur. Dass hier nicht sechs, sondern nur vier Liganden eintreten, hat seinen Grund in der Kleinheit der Fluorid-Ionen. Sie gehen so dicht an das Zentralteilchen heran, dass sie für weitere Liganden keinen Platz lassen. Das Wassermolekül ist dagegen größer und sperriger und kommt nicht so dicht an den Kern heran, lässt aber dadurch mehr Platz für weitere Liganden.
3 Beispiel Diamminsilber(I)-Kation
Ein anderes, etwas komplizierteres Beispiel ist das Diamminsilber(I)-Kation.
Gehen wir zum besseren Verständnis vom Silberatom aus. Es steht in der 9. Nebengruppe und gehört zu den Münzmetallen Cu-Ag-Au. Seine Elektronenkonfiguration im Grundzustand sieht für Laien etwas merkwürdig aus: Man erwartet, dass sich im 4d-Orbital 9 Elektronen befinden und im 5s-Orbital zwei. Jedoch „rutscht" ein Elektron der 5s-Schale in das 4d-Orbital und füllt es auf. Das hat natürlich (wie immer) energetische Gründe.
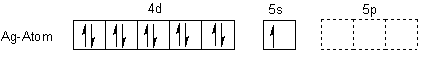
Im Komplex liegt das Silber-Kation vor. Also entfernen wir ein Elektron - natürlich das der 5s-Schale. Dann sieht das Ion energetisch richtig stabil aus!
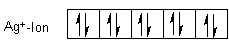
Nun geben wir zwei Ammoniak-Moleküle hinzu.
Jedes der beiden hat ein „nichtbindendes" Elektronenpaar, das auf Bindungs-Chancen wartet. Diese Paare klinken in die freien Plätze beim Ag-Ion ein. Wo sind da freie Plätze? Das sind die 5s und 5p-Orbitale, die sozusagen auf Besuch warten.
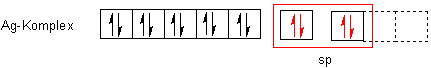
Für die Form der Anordnung der Liganden kommen nur zwei Strukturen in Frage: Gewinkelt oder linear gerade. Letzteres ist richtig. Denn die beiden neuen 5s und 5p-Orbitale kombinieren sich zu einem sp-Hybridorbital. sp-Hybridorbitale haben eine lineare Geometrie. (Wir kennen das vom Kohlenstoff: Struktur des Ethins.)
Aber die Theorie erklärt nicht alles.
Was man nicht so einfach verstehen kann und was auch Schülern und Studierenden
so Schwierigkeiten macht: Warum hat zum Beispiel der Tetraamminkupfer(II)-Komplex
eine quadratisch-planare Struktur und warum sind die Liganden im
Tetracyanocuprat(II)-Komplex tetraedrisch angeordnet? Darüber berichten wir in einer
anderen Webseite.
Weitere Texte zum Thema „Komplexverbindungen“