Für Spezialisten: Warum fluoreszieren manche Mineralien?
Fluoreszenz bedeutet Einstrahlung von Licht und rasches Wiederabstrahlen, wobei das abgestrahlte Licht langwelliger ist als das eingestrahlte. Für organische Farbstoffmoleküle kann man das Phänomen relativ leicht erklären. Ein Beispiel ist das Fluorescein.
Bei den fluoreszierenden Kristallen bzw. Festkörpern handelt es sich nicht um reine bzw. ideale, sondern stets um in ihrem Aufbau gestörte Kristalle. So fluoresziert z. B. Flussspat nur, wenn er gefärbt ist, weil er dann freie Ca- bzw. Fluor-Atome oder andere, fremde Atome enthält. In Ionenkristallen entstehen diese Atome z. B. durch radioaktive Bestrahlung. Wie diese Störungen Kristalle verändern, beschreiben wir hier am Beispiel des Silberbromids.
Normalerweise greift man zur Beschreibung von Spektren (z. B. von Gasen) auf diskrete Energiezustände zurück, die die einheitliche Lage der Energiezustände der Elektronen nach den Regeln der MO-Theorie beschreiben. Hier sind Beispiele aus der Komplex-Chemie.
Da im Kristall die Energie der Atome, Ionen und Elektronen noch durch Gitterschwingungen usw. beeinflusst wird, gibt es keine scharfen Orbitale, sondern nur quasikontinuierliche Energiesysteme, die Bänder.
Folglich greift man zur Erklärung der Fluoreszenz auf das MO-Modell für Festkörper, das
Energiebändermodell, zurück. In dem Modell unterscheidet man zunächst einmal zwei Bänder:
Einmal sind das die Energieterme der gebundenen Valenzelektronen im höchsten besetzten Energiezustand
(Grundzustand) der einzelnen am Gitteraufbau beteiligten Atome bzw. Ionen (Valenzband).
Das Leitungsband entspricht dem tiefsten unbesetzten Energiezustand der beteiligten
Atome; es wird im Anregungszustand von den Energietermen freier Elektronen gebildet.
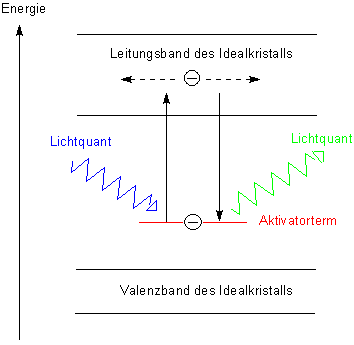
Das folgende Bild zeigt schematisch und stark vereinfacht das Bändermodell für einen Isolator-Kristall.

Zunächst befinden sich die Elektronen im Grundzustand im energieärmeren Valenzband. Das Leitungsband
liegt dagegen so hoch, dass die Lücke ohne deutliche Energiezufuhr nicht übersprungen werden kann. Dieser
Kristall ist also ein Isolator.
Befinden sich nun Störstellen, zum Beispiel Metallatome, im Kristall, so bekommt man zusätzliche Terme (Aktivatorterme), die zwischen dem Valenzband und dem Leitungsband liegen. (Der Grund: Metall-Atome haben eine höhere potentielle/chemische Energie als Metall-Ionen.) Durch Bestrahlung kann ein Elektron aus dem Aktivatoratom herausgelöst werden und dabei soviel Energie aufnehmen, dass es das Leitungsband erreichen kann. Hier (das heißt natürlich im Kristallgitter) diffundiert es mehr oder weniger lange herum, bis es wieder genügend Energie verloren hat, um wieder in das Valenzband des Aktivators zurückfallen zu können. Dabei gibt das Elektron seine restliche Energie wieder als Strahlung ab. Da es bei seinem „Exkurs“ Energie verloren hat, ist die abgestrahlte Strahlung langwelliger als die eingestrahlte Strahlung.
Nicht immer fällt das Elektron sofort in das Valenzband zurück, wenn die Anregung aufhört. Es kann im Leitungsband eine Nische besetzen, deren Energie etwas unterhalb der unteren Grenze des Leitungsbands liegt. Dann gibt es keine scheinbar augenblickliche Abstrahlung (Fluoreszenz), sondern eine zeitlich deutlich verzögerte Strahlung (Phosphoreszenz). Letztere wird ebenfalls durch Bestrahlung, aber auch durch moderate Energiezufuhr wie Erhitzen oder Verformen des Kristalls ausgelöst.
Besonders starke Fluoreszenz zeigen Fluorit (daher die Bezeichnung „Fluoreszenz“) sowie Uranmineralien bzw. Uransalze. Bei beiden ist die Ursache für die Fluoreszenz die Radioaktivität: Beim Flussspat betrifft dies die zurückliegende Bestrahlung, beim Uransalz die aktuelle Radioaktivität des Urans und seiner Zerfallsprodukte. Zum Beispiel werden bei der Beta-Strahlung aus den Atomkernen Elektronen freigesetzt. Diese reduzieren Metall-Ionen zu Metallen, die dann den Aktivatorterm besetzen. Aber auch die anderen Strahlungsarten können durch Anregung oder Stoßprozesse aus den Anionen Elektronen freisetzen, die dann auf die Metall-Kationen übertragen werden - wie es bei dem Fotografischen Prozess der Fall ist.

Fluoreszenz von Uranyl-Acetat; Anregungswellenlänge 366 nm
(Fotos: Blume)
Bleibt noch die Frage, warum nicht alle Mineralien fluoreszieren, denn schließlich gibt es wohl
kaum einen natürlich gewachsenen Kristall, der nicht irgendwelche Störstellen aufweist.
Zur Anregung der Fluoreszenz ist die Einwirkung von Strahlung mit energetisch wohl definierten Wellenlängenbereichen notwendig - diese sind von Substanz zu Substanz unterschiedlich. Außerdem kommt es auf die Konzentration der Störstellen und deren Auswirkung auf die spektrale Absorption (Extinktion), also auf den Extinktionskoeffizienten an.
Um neben der durch Strahlung induzierten Fotolumineszenz auch die Phänome Thermolumineszenz bzw. Triboluminenszenz umfassend zu erklären, muss man neben der Strahlung auch noch die anderen Formen der Anregung, die Leuchten zur Folge haben, wie Erhitzen oder Verformen der Kristalle, in Betracht ziehen.
Wir sehen also, dass das hier benutzte Modell noch einiger Verbesserungen bedarf. Aber für den ersten Überblick sollte das einfache Modell reichen.
Weitere Texte zum Thema „Kristalle“