Kohlenhydrate: Ein kleiner Überblick
Experimente:
Versuch: Fehling-Nachweis
Versuch: Nachweis von Glucose und Fructose mit der Silberspiegel-Probe
Versuch: Nachweis von Stärke in Lebensmitteln
Kohlenhydrate (Saccharide (sacchar = Zucker)) sind eine in der Natur weit verbreitete
Stoffgruppe mit der allgemeinen Summenformel:
CnH2nOn = Cn(H2O)n
Sie wurden ursprünglich als Verbindungen aus Kohlenstoff und Wasser aufgefasst und deshalb
als Hydrate des Kohlenstoffs (= Kohlenhydrate) bezeichnet.
Heute sind längst zahlreiche andere Verbindungen bekannt, die nicht dieser Formel entsprechen,
aber aufgrund ihres chemischen Verhaltens auch zu den Kohlenhydraten gehören.
Von allen organischen Verbindungen auf der Erde sind Kohlenhydrate am weitesten verbreitet und mengenmäßig bisher ungeschlagen. Sie kommen in Tieren wie Pflanzen vor und und haben die vielfältigsten Funktionen, so sind sie Gerüst- oder Reservestoff, Energielieferant oder Ballaststoff. Auch als Zusatzstoffe in Lebensmittel sind sie nicht mehr wegzudenken, denn sie haben technologische Eigenschaften, die prima genutzt werden können. Man verwendet sie daher z. B. als Süßungsmittel, Gelbildner, Dickungsmittel oder auch als Stabilisatoren.
Kohlenhydrate werden nach ihrer chemischen Struktur in Mono-, Di- und Polysaccaride eingeteilt:
Monosaccharide
Monosaccharide sind die einfachsten Kohlenhydrate. Strukturell enthalten sie neben einer mehr
oder weniger langen Kohlenstoffkette noch mindestens zwei Hydroxylgruppen sowie - im einfachsten
Fall - eine Aldehyd- oder eine Ketogruppe. Monosaccharide bezeichnet man daher auch als
Polyhydroxyaldehyde (= Aldosen) oder
Polyhydroxyketone (= Ketosen) bzw., je nach Anzahl
der C-Atome, z. B. als Pentosen oder
Hexosen. Wie du siehst, kann man Saccharide schon an der
Endung -ose erkennen, wie ein Enzym an der Endung -ase.
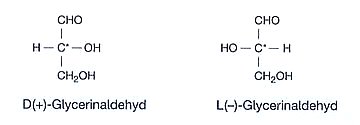
Die einfachsten Monosaccharide sind die Triosen Glycerinaldehyd und Dihydroxyaceton.
Glycerinaldehyd enthält im Gegensatz zu Dihydroxyaceton ein asymmetrisches
Kohlenstoffatom, also ein C-Atom, das vier verschiedene Atome bzw. Atomgruppen
trägt. Bedingt durch dieses Chiralitätszentrum gibt es
für die beiden Verbindungen zwei Stellungsisomere oder Enantiomere
(von griechisch: enantios, entgegengesetzt), die man als D- und als
L-Form bezeichnet. Das D steht für das lateinische Wort "dexter"
und bedeutet "rechts", das L steht für "laevus" und bedeutet "links". Man bezieht sich
dabei auf die Fischer-Projektionsformel, in der das Molekül
gestreckt so dargestellt wird, dass das am höchsten oxidierte C-Atom nach oben zeigt.
Die OH-Gruppe an dem am weitesten von dieser Gruppe entfernten asymmetrischen C-Atom kann
entweder nach rechts (D) oder nach links (L) zeigen. Entsprechend wird dem Namen der Verbindung
ein D oder L vorangestellt.
Baust du mit Hilfe eines Molekülbaukastens die beiden Formen nach, wirst du feststellen,
dass du die Atome und Atomgruppen drehen und wenden kannst wie du willst, du wirst die
beiden Moleküle nie zur Deckung bringen können. Man sagt, die Enantiomere verhalten
sich wie Bild und Spiegelbild oder wie eine rechte und linke Hand zueinander.

Von Bedeutung ist die Zuordnung zur D- oder L-Reihe meist nur im Rahmen biochemischer Prozesse.
Grundsätzlich weisen beide Enantiomere oder optische Antipoden
die gleichen chemischen und physikalischen Eigenschaften auf, jedoch sind viele physiologisch
wirksame Verbindungen nur in einer der beiden Formen wirksam. Ascorbinsäure wirkt nur als
Vitamin in der L-Form und der Stoffwechsel des menschlichen Körpers vermag
ausschließlich L-Milchsäure zu bilden und mit Hilfe des speziellen Enzyms
L-Lactat-Dehydrogenase abzubauen.
Bei den Kohlenhydraten sind in der Regel nur die Verbindungen der D-Reihe von Bedeutung.
Wird unterhalb der Aldehyd- oder Keto-Gruppe schrittweise eine neue CHOH-Gruppe eingefügt, die ihrerseits wieder ein asymmetrisches C-Atom (allgemein gekennzeichnet mit einem Sternchen: C*) mitbringt, entsteht der Stammbaum der Aldosen. D-Glycerinaldehyd ist sozusagen die "Stammmutter" der D-Aldosen. Entsprechend leiten sich die D-Ketosen vom Dihydroxaceton ab.
Wichtige Zucker sind z. B. die Glucose, besser bekannt unter dem Namen Traubenzucker, Fructose, die man auch als Fruchtzucker bezeichnet und die Galactose, dem Schleimzucker. Sie kommen in vielen Lebensmitteln vor, sei es als Mono-, Di- und auch Polysaccharid.
Die Optische Aktivität als charakteristische Stoffeigenschaft
Verbindungen, die vier verschiedene Atomgruppen in ihrem Molekül aufweisen, also ein
asymmetrisches C-Atom enthalten, sind optisch aktiv.
Optisch aktive Substanzen drehen die Schwingungsebene des linear polarisierten Lichts um
einen ganz bestimmten Betrag nach rechts (+) oder links (-). Es handelt sich bei diesem
Drehwinkel um eine substanzspezifische Größe, mit der man
auch unbekannte Zuckerkonzentrationen messen kann. Geräte, mit denen diese Messungen
vorgenommen werden, sind Polarimeter. Ob ein Molekül rechts- oder linksdrehend ist,
kann nicht wie die D- und L-Form anhand der Struktur festgemacht werden. Es handelt sich
hierbei um eine Angabe, die nur auf experimentellem Weg ermittelt werden kann. Wichtig zu
wissen ist, dass zwischen dem Drehsinn der Polarisationsebene (+/-) und der D/L-Konfiguration
einer Verbindung kein Zusammenhang besteht.
Ringstruktur der Monosaccharide
Einfachzucker können durch eine intramolekulare Reaktion der Aldehyd- oder Ketogruppe mit
einer alkoholischen OH-Gruppe cyclische Halbacetale oder -ketale bilden. So entstehen
fünfgliedrige Furanosen und sechsgliedrige Pyranosen, abgeleitet von den
ähnlich aufgebauten organischen Verbindungen Pyran und Furan.
Bei dem Ringschluss wird das C-Atom, welches zuvor die Aldehyd- oder Ketogruppe getragen
hat, selbst asymmetrisch, wodurch zwei Stellungsmöglichkeiten der neu gebildeten OH-Gruppe
entstehen, eine a- und eine
b-Form. Zwei Zucker, die sich nur durch die
Stellung der glykosidischen OH-Gruppe unterscheiden, bezeichnet man
als Anomere.
Die folgende Abbildung gibt den Ringschluss in der Fischer-Projektion
wieder. Dabei zeigt die glykosidische OH-Gruppe in der a-Form
nach rechts, in der b-Form nach links.
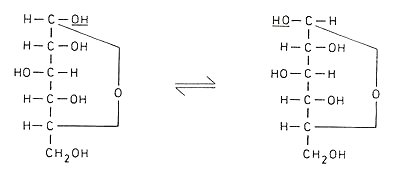 |
| Ringschluss nach Fischer |
Eine weitere Darstellung, in der man die räumliche Struktur besser erkennen kann, ist die
Haworth-Projektion.
Der Zucker ist ein ebener Ring, in der der Ringsauerstoff nach hinten liegt und die
endständige CH2OH-Gruppe bei der D-Reihe nach oben, in der L-Reihe nach unten zeigt.
Die glykosidische OH-Gruppe steht in der a-Form unten und
in der b-Form oben.
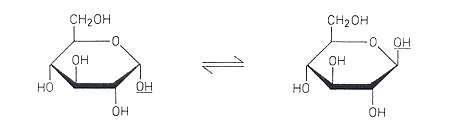 |
| Ringschluss nach Haworth |
In wässriger Lösung können sich die beiden anomeren Formen über eine
Ringöffnung ineinander umwandeln, bis sich ein bestimmtes Verhältnis zwischen
a- und b-Form einstellt.
Man bezeichnet diesen Vorgang als Mutarotation, wobei sich der Drehsinn
so lange ändert, bis er sich auf einen konstanten substanzspezifischen Wert eingependelt hat.
Disaccharide
Verbinden sich zwei Monosaccharide miteinander, so entsteht ein Disaccharid.
Das bekannteste Disaccharid ist die Saccharose oder der Rohrzucker. Das ist übrigens
der Zucker, den du auch als "Zucker" kennst, nämlich ganz normaler Haushaltszucker.
Er ist aus Glucose und Fructose zusammengesetzt.
Ein weiteres wichtiges Disaccharid, das aus zwei Glucosemolekülen besteht, ist die
Maltose, der Malzzucker. Dieses Disaccharid tritt überall da auf, wo ein biologischer
Abbau von Stärke stattfindet, denn Stärke ist ein aus vielen Glucoseeinheiten
aufgebautes Polysaccharid, das durch Enzyme bis zur Maltose abgebaut werden kann.
Dann gibt es noch die in der Milch vorkommende und daher auch als Milchzucker bekannte
Lactose. Sie ist ein Zusammenschluss von einem Galactose- und einem
Glucosemolekül.
Alle Disaccharide sind optisch aktiv, bilden a- und b-Anomere und haben einen süßen Geschmack, der allerdings unterschiedlich ausgeprägt ist.
Was Disaccharide aber nicht alle gemeinsam haben ist die Reduzierbarkeit. Während alle Monosaccharide reduzierende Zucker sind, ist diese Eigenschaft nicht automatisch bei den Disacchariden gegeben. Die Fähigkeit zu reduzieren beruht auf der Art der Verknüpfung. Ist eine der glykosidischen Gruppen im Disaccharid noch ungebunden, wirkt er reduzierend. Zu diesen Zuckern gehören die Maltose und Lactose. Sind - wie bei der Saccharose - beide glykosidischen Gruppen blockiert, liegt ein nichtreduzierender Zucker vor. Auf der Reduzierbarkeit beruht der Fehling-Nachweis. Die tiefblaue Fehlingsche Lösung, die ein Gemisch aus gleichen Teilen Kupfersulfat-Lösung und alkalischer Natrium-Kalium-Tartrat-Lösung ist, verfärbt sich nach Zugabe eines reduzierenden Zuckers und anschließendem Kochen zunächst grün, dann braun und zuletzt kräftig hellrot, denn es setzt sich ein roter Niederschlag von Kupfer(I)oxid ab. Saccharose als nichtreduzierender Zucker zeigt diese Reaktion nicht. Führt man aber eine Inversion durch, wird durch die Einwirkung der Säure das Disaccharid in seine Bausteine Glucose und Fructose gespalten. Beide entstandenen Zucker sind reduzierend, so dass die Reaktion jetzt positiv verläuft. Der Versuch spielt auch in der quantitativen Analyse von Zuckern eine große Rolle.
Polysaccharide
Polysaccharide (Glycane) bestehen wie die Disaccharide aus Einfachzuckern, die über
Glykosidbindungen miteinander verknüpft sind (Verbindung einer glykosidischen OH-Gruppe
des einen Moleküls mit einer alkoholischen OH-Gruppe eines anderen Moleküls).
Dabei ergibt sich neben der linearen Anordnung auch noch die Möglichkeit der Verzweigung.
Ein dir bekanntes Polysaccharid, das beispielsweise linear aufgebaut ist, ist die
Cellulose. Sie ist Hauptbestandteil pflanzlicher Zellwände.
Da Cellulose nur aus b-Glucosemolekülen zusammengesetzt ist,
handelt es sich um ein Homoglycan. Im Gegensatz dazu sind
Heteroglycane aus mehreren Bausteinen aufgebaut.
Ein weiteres wichtiges Homoglycan ist die Stärke. Sie besteht allerdings aus zwei
Komponenten: der Amylose und dem Amylopektin. Amylose besteht aus
a-Glucosemolekülen, die über eine
1,4-glykosidische Bindung miteinander verknüpft sind.
Es handelt sich um ein lineares Molekül, das sich in einer spiralförmigen
Helix windet. Einige Moleküle, wie z. B. Iod, geben mit Amylose Einschlussverbindungen.
Auf dieser Fähigkeit beruht auch der
Nachweis von Stärke in Lebensmitteln.
Amylopektin ist im Gegensatz zu Amylose ein verzweigtes Glycan. Die Verzweigung kommt durch
zusätzliche, allerdings unregelmäßig auftretende
a-1,6-Verknüpfungen zustande.
Stärke ist als Reservekohlenhydrat in den verschiedensten Organen von Pflanzen anzutreffen. Als Bestandteil vieler Lebensmittel ist sie auch für uns unentbehrlich, denn sie stellt die wichtigste Kohlenhydratquelle für unsere Ernährung dar.
Es gibt noch viele weitere Polysaccharide, auf die hier allerdings nicht näher eingegangen werden soll. Wie auch die Stärke finden die meisten - ursprünglich oder modifiziert - als Dickungsmittel in Lebensmitteln Verwendung.
Weitere Texte zum Thema „Milch“