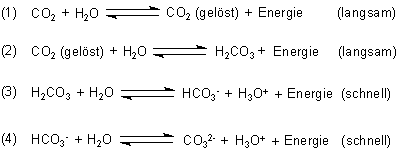
Das heterogene Gleichgewichtssystem Kohlenstoffdioxid / Wasser
Experimente:
Versuch: Kohlenstoffdioxid entsteht bei Verbrennungsvorgängen und Atmung
Versuch: Versuche um Kohlenstoffdioxid und Wasser
Versuch: Änderung der elektrischen Leitfähigkeit beim Einleiten von CO2 in Wasser
Versuch: Protolyse von Hydrogencarbonat und Carbonat
Versuch: Erwärmen von calciumhydrogencarbonat-haltigem Mineralwasser
Versuch: Modellexperiment zur Karst- und Tropfsteinbildung
Kohlenstoffdioxid entsteht bei Verbrennungsvorgängen und Atmung (->
Versuch). Pro Tag bildet ein Mensch etwa einen Kilogramm CO2! Das Gas
muss aus dem Körper abtransportiert werden. Das geschieht zunächst durch
Gleichgewichtsreaktionen unter Beteiligung von Wasser. Das Gleichgewichtssystem
CO2 / H2O ist deshalb von größter Bedeutung für unser Leben.
Am System sind folgende physikalische sowie chemische Gleichgewichte beteiligt, die sich zudem unterschiedlich schnell einstellen.
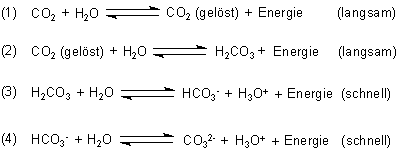
Diese Gleichgewichte stellen sich alle in mehr oder weniger großem Umfang ein, wenn man CO2 in Wasser einleitet. Dann bilden sich auch Ionen, was an der Zunahme an Leitfähigkeit gezeigt werden kann (-> Versuch). Aufgrund der Protonenfreisetzung gleitet der pH-Wert ins Saure ab (-> Versuch).
Diese Gleichgewichte kann man schrittweise verschieben. Da sie sich alle untereinander bedingen, haben wir es bei der Beeinflussung eines Gleichgewichts immer mit einer ganzen Antwort-Kaskade zu tun.
Temperaturänderung
Beim Abkühlen wird mehr CO2 gelöst.
Temperaturabhängigkeit der Löslichkeit von
CO2 in Wasser (1,013 bar)
20 °C
15 °C
0 °C0,9 l CO2 / l Wasser
1 l
1,7 l
Dann ziehen auch die Folgegleichgewichte
verstärkt nach, und zwar auf die Richtung ihrer rechten Seiten.
Erwärmt man zum Beispiel eine wässrige CO2-Lösung, so treibt man damit CO2 aus,
folglich verschieben sich alle Gleichgewichte in Richtung auf die linke Seite in die
große Richtung (1) und dieses sich auf die linke Seite. (Deshalb sollte man
Sprudelflaschen nicht erwärmen. Unter dem Druck, der sich aufbaut, können die
Flaschen explodieren.)
Druckänderung
Erhöht man den Druck über einer CO2-Lösung, löst sich mehr CO2.
Druckabhängigkeit der Löslichkeit von
CO2 in Wasser (20 °C)
1,013 bar
25 bar 0,9 l CO2 / l Wasser
16,3 l
Dadurch ziehen auch die anderen Gleichgewichte nach. Nimmt man den Druck wieder weg, so tritt das CO2 wieder aus, alle anderen Gleichgewichte ziehen nach links nach. Deshalb schäumt Champagner nach dem Öffnen seiner normalerweise unter einem Druck von 5 bar stehenden Flasche zunächst kräftig aus, um dann "gemütlich" weiterzuperlen.
Konzentrationsänderung
Auch an den Konzentrationen der Reaktionspartner im CO2/ H2O-Gleichgewichtssystem
kann man drehen. Erhöht man die Konzentration der
Protonen (Hydronium-Ionen), so verschiebt man das Gleichgewicht in Richtung auf
freies CO2. Beim Ansäuern einer CO2-Lösung gast deshalb CO2
aus. Leitet man CO2 dagegen nicht in Wasser, sondern in Natronlauge ein, so verschiebt man
das Gleichgewicht dergestalt, dass sich sehr viel mehr CO2 löst, da die Hydroxid-Ionen
die Protonen aus den Gleichgewichten entfernen und die Reaktionen in die
Richtung auf Bildung von zunächst Hydrogencarbonat- und dann Carbonat-Ionen
zwingen.
Merkwürdige Gleichgewichtskonstanten
Kohlensäure ist eine zweiprotonige Säure. Die erste Säurekonstante ist pK1 = 3,88
(Gleichgewicht (3)). Das bedeutet, dass Kohlensäure eine mittelstarke Säure sein
sollte. Den Wert erhält man aber nur, wenn man ausschließlich von der "echten"
H2CO3 ausgeht. Jedoch liegen 99,8 % des gelösten CO2 gar nicht als Säure,
sondern nur als hydratisiertes Gas vor. Deshalb formuliert man eine "scheinbare"
Dissoziationskonstante, die um den Faktor 1000 kleiner ist. Dieser pK1-Wert beträgt
6,35.
Die zweite Säurekonstante, die das Dissoziationsgleichgewicht (4) beschreibt,
beträgt pK2 = 10,33.
Protolyse der Carbonate
Geht man umgekehrt von den Salzen aus, so findet Protolyse statt (->
Versuch). Das Hydrogencarbonat
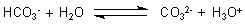
bewirkt eine schwach saure bis neutrale Reaktion. Dagegen reagiert das Carbonat mit Wasser unter Bildung von Hydroxid-Ionen, bewirkt also eine alkalische Reaktion.
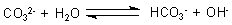
Die Gleichgewichtseinstellung der Kohlensäurebildung im Blut erfolgt
enzymatisch
Wir hatten gesehen, dass sich das Gleichgewicht (2) sehr langsam einstellt. Das
wäre für unseren Organismus schlecht. Nun gibt es glücklicherweise ein Enzym,
das die Einstellung des Gleichgewichts beschleunigt. Dieses wichtige Enzym, das
sich in großer Konzentration in den roten Blutkörperchen befindet, setzt pro
Molekül in einer Minute 36 Millionen Moleküle CO2 mit Wasser um. Damit ist es
eines der aktivsten Enzyme überhaupt. Sein Name ist Carbonat-Dehydratase oder
auch Carboanhydrase. Es trägt im aktiven Zentrum übrigens ein Zink-Ion.
Das CO2 / Wasser-Puffersystem
Das CO2/Wasser-System ist wie alle Säure/Base-Gleichgewichte ein
hervorragender Puffer. Er hat nicht nur Bedeutung für die Wasserqualität, sondern
ganz besonders bei der Regulation des Blut-pH-Werts. Das liegt nicht so sehr an
seiner Konzentration (ausgedrückt durch die Pufferkapazität),
sondern daran, dass am Ende der Kette gasförmiges CO2 steht, das ausgeatmet
wird. Im Gegenteil: Zuviel Carbonat bzw. Hydrogencarbonat im Blut würde den Blut-pH-Wert
ins Alkalische bzw. Saure abgleiten lassen.
Protonen reagieren mit Hydrogencarbonat-Ionen zu Kohlensäure, die dann zerfällt.
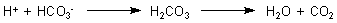
Nun bilden sich entsprechend dem Gleichgewicht (3) aber auch Protonen bei der Bildung von neuen Hydrogencarbonat-Ionen. Führt das nicht insgesamt zu einer Versauerung des Körpers? Man muss bedenken, dass es auch Basen gibt, die neutralisiert werden müssen. Die wichtigste ist das Ammoniak, das in großen Mengen bei Desaminierungen von Aminosäuren usw. entsteht.
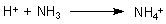
Die Ammonium-Ionen werden über die Niere ausgeschieden. Somit sind sie der Haupttransporteur der Säureprotonen.
Wie Tropfsteine entstehen
In Wasser ist CO2 gelöst. Der Vorgang ist reversibel.
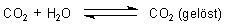
Ein Teil davon bildet Kohlensäure.
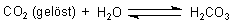
Die löst den Kalk auf.
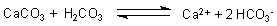
So entstehen die großen Karsthöhlen.
Aber auch die Kalkauflösung ist eine reversible Reaktion. Ihre Richtung hängt von
der Konzentration an gelöstem CO2 ab. Ist viel da, löst sich Kalkstein auf. Ist wenig
da, bildet er sich wieder. Das hängt auch von der Temperatur ab. Beim Erwärmen fällt der Kalk wieder
aus - wie man in einem Versuch zeigen kann.
Wenn dieses Wasser, in dem Calcium- und Hydrogencarbonat-Ionen gelöst sind,
einen dünnen Flüssigkeitsfilm bildet, gibt es in Umkehrung der obigen Reaktionen
verstärkt CO2 an die Außenluft ab.
Dann läuft die obige Reaktion der Auflösung von Kalkstein durch Kohlensäure
umgekehrt ab. Es kristallisiert Kalk aus; eine feine Kalkschicht entsteht. Ein
Tropfstein bildet sich. Man spricht von Stalagtiten.
Der Gasaustausch findet auch statt, wenn ein Wassertropfen auf den Boden fällt
und zerstäubt. Dabei wird eine große Flüssigkeitsoberfläche gebildet. Der sich
bildende Stalagmit wächst dem Stalagtiten entgegen.
(Zu all diesen Zusammenhängen haben wir ein Modellexperiment.)

Tropfsteinhöhle in Minas Gerais, Brasilien
(Foto: Susanne Hoffmann)
Wie Meeresorganismen unsere Atmosphäre vom CO2 befreien halfen (und
noch helfen)
Hierzu haben wir eine Webseite, die Sie anschauen sollten.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“