Eine Einführung in die Grundlagen zum chemischen Gleichgewicht
Die Umkehrbarkeit chemischer Reaktionen
Experimente:
Versuch: Knallgasreaktion
Versuch: Elektrolyse von Wasser
Versuch: Säurekatalyse bei der Estersynthese
Vollständig ablaufende chemische Reaktionen sind selten und nur unter
Energieaufwand umkehrbar
Viele chemische Reaktionen sind scheinbar mit der vollständigen Umwandlung der
Ausgangsstoffe in Reaktionsprodukte beendet. Ein spektakuläres Beispiel ist die
Knallgasreaktion (-> Versuch). Hier verbinden sich in exothermer
Reaktion Wasserstoff und Sauerstoff miteinander zu Wasser. Das heißt: Je ein
Sauerstoffatom reagiert mit zwei Wasserstoffatomen zu einem Wassermolekül.
2 H2 + O2 ———> 2 H2O / exotherm
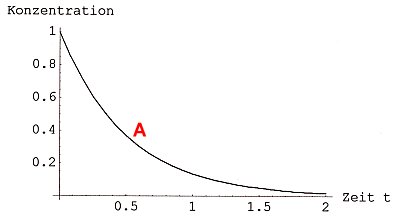
Die Ausgangsstoffe (Edukte) reagieren augenscheinlich vollständig miteinander. Ihre Konzentration sinkt dabei auf Null. Ein Bild des Verlaufs der Konzentration der Ausgangsstoffe mit der Zeit zeigt das Bild 1.

Bild 1a: Abklingkurve des Eduktabbaus einer vollständig ablaufenden chemischen Reaktion
Man kann aber auch das Diagramm der Konzentration des Produkts gegen die Zeit
malen. Die Kurve steigt zunächst an und geht auf den Wert der Konzentration des
Edukts.
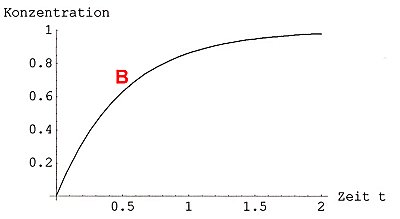
Bild 1b: Sättigungskurve der Produktbildung einer vollständig ablaufenden chemischen Reaktion
Beide Diagramme in ein Bild gezeichnet ergeben spiegelbildliche Kurven.
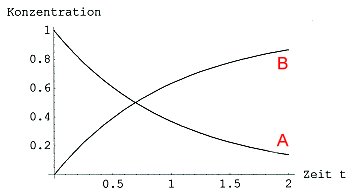
Bild 1c: Abkling- und Sättigungskurven einer vollständig ablaufenden chemischen Reaktion
Man kann diese Reaktion aber auch rückwärts laufen lassen. Dazu muss man zu
Wasser Energie zuführen. Das geschieht im Allgemeinen durch elektrische Energie
bei der Elektrolyse. Die Rückreaktion wird somit endotherm.
2 H2O ———> 2 H2 + O2 / endotherm
Die meisten chemischen Reaktionen verlaufen aber nur selten
vollständig
Ein Beispiel dafür ist die Esterbildung aus einem Alkohol und Säure wie z. B.
Ethanol und Essigsäure. Diese Reaktion wird
bekanntlich durch Schwefelsäure als Katalysator
beschleunigt.
C2H5OH + CH3COOH ———> C2H5-O-CO-CH3 + H2O / exotherm
(Dass die Reaktion schwach exotherm ist, erkennt man nicht auf den ersten Blick. Denn zum Aktivieren müssen wir die Mischung erwärmen.)
Das sieht nach vollständigem Umsatz aus. Wenn man jedoch Ethanol und Essigsäure in einem geschlossenen Gefäß im Stoffmengenverhältnis 1 mol : 1 mol mischt und mit Schwefelsäure als Katalysator versetzt, reagieren nur 67 % der Ausgangsstoffe zu Ester und Wasser. 33 % der Ausgangsstoffe bleiben unverändert. Die Konzentration der Ausgangsstoffe und der Reaktionsprodukte ändert sich nach einiger Zeit nicht mehr. Es gibt auch eine Abklingkurve, aber die landet nicht bei der Konzentration Null (-> Bild 2), sondern wie hier bei 33 %.
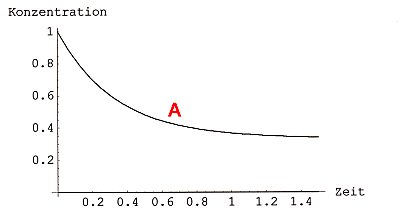
Bild 2a: Abklingkurve einer nicht vollständig ablaufenden chemischen Reaktion
Wenn die Produkte der Hinreaktion die Edukte der Rückreaktion
werden
Die bislang besprochene Reaktion zur Esterbildung nennen wir „Hinreaktion". Wie
wäre es, wenn wir umgekehrt eine Mischung aus Ester und Wasser vorlegen, also
eine „Rückreaktion" einleiten? Natürlich müssen die Reaktionsbedingungen bei der
Rückreaktion die gleichen sein wie bei der Hinreaktion, also wie beim vorherigen
Versuch. Deshalb müssen wir auch diesmal Schwefelsäure als Katalysator zugeben
und erwärmen. Diesmal ist die Reaktion natürlich schwach endotherm und wird aktiviert.
C2H5-O-CO-CH3 + H2O ———> C2H5OH + CH3COOH / endotherm
Wir beobachten, dass unter diesen Bedingungen das Ganze umgekehrt abläuft. Nach einiger Zeit enthält die Reaktionsmischung nur noch 67 % Ester und 33 % der unveränderten Edukte, bleibt dann aber „stehen".
Esterbildung und Esterspaltung sind leicht umkehrbar, reversibel. Das zeigt Bild 2b. Ursache ist die äußerst geringe Redaktionsenergie, die bei der Bildungsreaktion freigesetzt wird. Sie beträgt nur -3,2 kJ/mol.
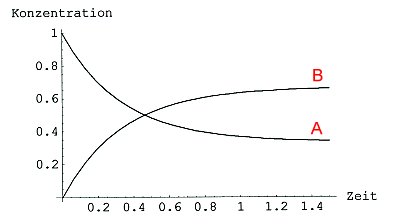
Bild 2b: Abkling- und Sättigungskurven einer nicht vollständig ablaufenden chemischen Reaktion (Gleichgewichtsreaktion)
Was beim reversiblen System von Esterbildung und Esterhydrolyse auf
molekularer Ebene abläuft
Bei der Esterbildung reagiert jeweils ein Säuremolekül mit einem Alkoholmolekül.
Dabei entstehen ein Estermolekül und ein Wassermolekül. Nun stellen wir fest,
dass umgekehrt Ester durch Zugabe von Wasser gespalten werden können.
Esterbildung und Esterspaltung sind also umkehrbar. Das drücken wir durch einen
Doppelpfeil in der Reaktionsgleichung aus.
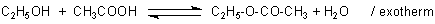
Solche leicht umkehrbaren Reaktionen verlaufen nicht vollständig auf die eine oder
auf die andere Seite. Die Konzentration der Ausgangsstoffe sinkt nicht auf Null. Die
Reaktion scheint zum Stillstand zu kommen, egal ob wir vom Alkohol/Säure-Gemisch oder
vom Ester/Wassergemisch ausgehen. Stets landen beide Reaktionsansätze bei den gleichen
Konzentrationswerten, den Gleichgewichtskonzentrationen.
Die kleinsten Teilchen, aus denen Materie besteht, also Atome, Moleküle oder
Ionen, befinden sich in ständiger Bewegung. Sie stoßen dabei ständig zusammen.
Das ist die Voraussetzung für das Zustandekommen einer chemischen Bindung. Da
muss man aber fein unterscheiden:
Zunächst können die Teilchen wie Billardkugeln zusammenstoßen, dann prallen sie
wieder voneinander ab. Diese Zusammenstöße sind chemisch unwirksam. Wenn
sich die Teilchen aber an der richtigen Stelle treffen, finden chemisch wirksame
Zusammenstöße zwischen den Molekülen statt.
Das heißt, wenn Alkoholmoleküle mit Säuremolekülen an den richtigen Ecken
zusammenstoßen, entstehen Estermoleküle und Wassermoleküle. Das ist die
Hinreaktion. Gleichzeitig stoßen umgekehrt aber auch Wassermoleküle mit
Estermolekülen wirksam zusammen. So entstehen wieder Alkoholmoleküle und
Säuremoleküle (Rückreaktion).
Da diese Zusammenstöße zur Esterbildung und Esterspaltung gleichzeitig
stattfinden, ist keine messbare Veränderung festzustellen. Man sagt: Es hat sich
ein chemisches Gleichgewicht eingestellt.
Dabei handelt es sich um ein dynamisches Gleichgewicht. Das bedeutet, obwohl
man von außen keine Veränderung der Konzentrationen der Stoffe beobachten
kann, finden ständig chemische Reaktionen zwischen den Teilchen statt, die man
als Hinreaktion und als Rückreaktion bezeichnet. Die Ausgangsstoffe wie auch die
Reaktionsprodukte reagieren und entstehen gleichzeitig in gleicher Menge.
Gleichgewichte können beeinflusst werden
Wenn sich bei einer chemischen Reaktion das Stoffgemisch im chemischen
Gleichgewicht befindet, kann das Gleichgewicht durch Veränderung der
Reaktionsbedingungen gestört werden. Dabei spielen z. B. Temperaturänderung,
Änderung der Konzentration eines der beteiligten Stoffe oder bei Gasreaktionen
eine Druckänderung eine Rolle. Das besprechen wir in einer gesonderten
Webseite.
Text erweitert nach: R. Blume, W. Kunze, H. Obst, E. Rossa und H. Schönemann: Natur und Technik, Chemie 8-10, Sekundarstufe I Rheinland-Pfalz, Cornelsen-Verlag, Berlin 1999.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“