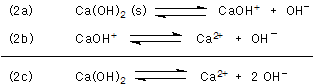
Die Löslichkeit von Calciumhydroxid
Experimente:
Versuch: Löslichkeit von Calciumhydroxid
Calciumdihydroxid Ca(OH)2 ist ein weißes Pulver. Es löst sich kaum in Wasser, sondern
bildet eine Aufschlämmung (Suspension). Das kennen wir von der Herstellung von
Kalkmörtel. Eine Aufschlämmung ist eine gesättigte Lösung.
Dass sich überhaupt etwas löst, erkennt man an folgendem: Die Aufschlämmung
reagiert stark alkalisch (-> Versuch).
Zum Herstellen von Calciumhydroxid geht man zweckmäßigerweise von Calciumoxid CaO (gebrannter Kalk) aus. Zunächst bildet CaO mit Wasser in exothermer Reaktion Calciumhydroxid ("Kalklöschen").
(1) CaO + H2O ———> Ca(OH)2 + Energie
Die gesättigte Lösung von Calciumhydroxid hat einen pH-Wert von 12,75 (25 °C). Nun sollte man annehmen, dass man mit Hilfe des pH-Werts die Konzentration der OH--Ionen berechnen können müsste, um so das Löslichkeitsprodukt zu ermitteln. Das geht aber nicht so einfach. Calciumhydroxid gehört nämlich zu den schwachen Basen - auch wenn es relativ stark alkalisch wirkt. Denn seine Dissoziation erfolgt in zwei Stufen; es handelt sich also um Gleichgewichtsreaktionen.
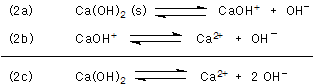
Ihre Gleichgewichtskonstanten kann man einmal als Basen-Konstante pKb und mit Hilfe des Ionenprodukts
des Wassers (pH + pOH = 14) auch als Säure-Konstante pKa formulieren:
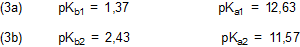
Den pKb-Werten entnimmt man, dass die erste Stufe (Ca(OH)2) die etwa 10fach stärkere Base ist
und mehr Hydroxid-Ionen liefert. Die pKa-Werte beschreiben das Ganze aus der entgegengesetzten Sicht: Man
muss den Protonendruck der Lösung erhöhen, damit auch die zweite Stufe (CaOH+) dissoziiert.
Die pKa- bzw. pKb-Werte liegen so nah zusammen, dass man in der Titrationskurve keine zwei Wendepunkte erkennen kann. Getrennte Dissoziationsstufen erkennt man erst ab Δ pK = 1,2, genau erst ab 2. In manchen Tabellenwerken ist nur ein pKa-Wert angegeben, z. B. 12,6 in [1].
Um zum Löslichkeitsprodukt zu gelangen, muss man genau berechnen, in welchen Konzentrationen die Spezies Ca2+, CaOH+ sowie OH- beim gemessenen pH-Wert 12,75 vorliegen. In diesem Zusammenhang sollte man sich die Dissoziationskurven von zweistufigen Säure/Base-Reaktionen ansehen.
Das ist alles sehr kompliziert. Das Löslichkeitsprodukt müssen wir aber kennen, denn mit seiner Hilfe können wir berechnen, wie viel Calciumhydroxid sich in einem Liter Wasser löst. Gleich vorneweg: Der Literaturwert für diese Menge ist 1,26 g/l (25 °C) [2].
Wir verwenden deshalb hier zunächst ohne Nachfrage den Literaturwert für das Löslichkeitsprodukt (25 °C) [1].
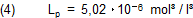
Allerdings ist nicht klar, welcher Vorgang hiermit gemeint ist. Deshalb wissen wir auch nicht, wie das Löslichkeitsprodukt
definiert ist. Wir beziehen uns zunächst auf die vollständige Dissoziation, wie sie die Gesamtgleichung (2c) beschreibt. Dann
ist Lp wie folgt zu definieren:

Die Umformung ergibt den gesuchten Wert für die Konzentration der Calcium-Ionen in der gesättigten Lösung:
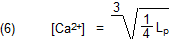
Mit dem Literaturwert für Lp (Gl. 4) ist die molare Sättigungskonzentration:
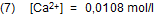
Die Sättigungsstoffportion β von Calciumhydroxid in einem Liter Lösung ist dann mit M Ca(OH)2 = 74,08 g/mol:
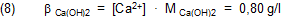
Der Wert ist verglichen mit dem aus der Literatur (β = 1,26 g/l) viel zu niedrig.
Jetzt kommt´s: Wenn wir, statt Gleichung (6) zu nutzen, probeweise nur die Kubikwurzel aus dem gesamten
Löslichkeitsprodukt ziehen (was wir eigentlich gar nicht dürften), kommt prompt das „Richtige“ bzw. „Erwartete“ heraus:
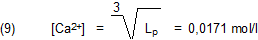
Denn dann ist die Stoffportion β von Calciumhydroxid in einem Liter gesättigter Lösung:
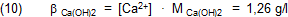
Daraus ist zu schließen, dass die Leute, von denen der Wert für Lp stammt, erst die Stoffmenge des gelösten
Ca(OH)2 in der gesättigten Lösung gemessen haben. Dann wurde mit Hilfe von Gl. (5a) der Wert von Lp
berechnet, indem für alle drei Konzentrationen der Wert 0,0171 mol/l eingesetzt wurde.
Übrigens gibt es wohl noch für Lp den Wert 4 • 10-6 mol3 / l3. Wenn man den nutzt, um mit (9) den Wert für die Stoffmenge zu berechnen, erhält man nur 0,0159 mol/l bzw. 1,18 g/l.
Zum Schluss: Wie gefährlich ist eigentlich Kalkwasser?
Die Lösung heißt "Kalkwasser" und dient in der Schulchemie im Allgemeinen zum Nachweis von Kohlenstoffdioxid - und das schon
im Anfangsunterricht! Schüler müssen dazu mit einem Trinkhalm in eine
Kalkwasserlösung pusten. Diese Lösung vermag durchaus Schleimhäute und vor allem die Hornhaut der Augen zu verätzen. Wir
führen sie deshalb in unseren Webseiten als Stoff mit dem Gefahrensymbol C (stark ätzend).
In den Tabellen liest man zwar, dass sich "nur" 1,26 g Ca(OH)2 in einem Liter Wasser lösen. Obwohl das wenig zu sein scheint, muss man Folgendes bedenken: Obwohl sie nur eine schwache Base ist, bildet sie eine stark alkalische Lösung.
Dennoch wird diese Substanz in den für die Schulen gültigen Vorschriften als "irritierend", also nur als Xi-Stoff, geführt. Grund: Die Konzentration an OH--Ionen liege unter... und sei damit für einen C-Stoff entsprechend der Gefahrstoffverordnung zu gering (!). Darauf weisen mich Sicherheitsspezialisten tatsächlich immer wieder hin und fordern mich außerdem auf, statt (C) das Gefahrensymbol (Xi) zu verwenden. Als wenn wir uns hier einer Industrienorm unterwerfen müssten!
Sicherheit im Chemieunterricht ist für mich in erster Linie nicht eine Frage der Vorschriften, sondern der Vermeidung möglicher Gefahren für Schüler und Lehrer. Man sollte sich also nicht immer verbeugen vor dem berühmt-berüchtigten Gesslerhut, vor von Schreibtischtätern verfassten Vorschriften.
Denken Sie stets daran: Schon stark verdünnte alkalische Lösungen können (anders als entsprechende Säurelösungen) überaus ätzend wirken. Das gilt übrigens auch für Lösungen der "schwachen" Base Ammoniak.
Aus diesem Grunde hat ein Versuch wie der Nachweis von Kohlenhydraten mit Hilfe der Fehlingschen Lösungen oder mit Haines Reagenz im Grundschul- oder Anfangsunterricht nichts zu suchen.
(Als Ersatzstoff bietet sich das kaum irritierende, auf der Alkalinität von Sodalösungen beruhende Benedict-Reagenz an.)
Literatur
[1] Handbook of Chemistry and Physics. CRC Press. New York, 2008-2009.
[2] A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie, Walter de Gruyter, Berlin, New York (neueste Auflage).
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“