Wie sich Salzkristalle lösen
Experimente:
Klicke hier
Kochsalz besteht aus Ionen, elektrisch geladenen Teilchen. Positiv (Na+) und negativ
(Cl-) geladene Ionen ziehen sich an und bilden das Kristallgitter.
Wasser dagegen besteht aus Molekülen, die elektrische Dipole sind.
Beim Lösungsvorgang geht es um die physikalische Wechselwirkung zwischen den Ionen und den Wassermolekülen. Die Vorgänge laufen an der Phasengrenze Kristalloberfläche/Wasser ab.
(Hierzu haben wir einen Schülerfilm.)
Die Wassermoleküle heften sich an die äußeren Ionen und polarisieren diese. Damit wird die interionische Anziehungskraft geringer; die Wasserdipole vermögen sich zwischen die Ionen zu schieben. Dann umhüllen sie die abgelösten Ionen und transportieren sie von der Kristalloberfläche weg. (Wenn das Wasser verdampft wird, läuft der umgekehrte Vorgang ab. Dann können die Ionen des Salzes sich wieder anziehen und das Gitter erneut aufbauen.)
Um jedes gelöste Ion sammeln sich in exakter geometrischer Anordnung sechs Wassermoleküle. Man spricht von Hydrathüllen. Beim Kochsalz sind sie oktaedrisch angeordnet.
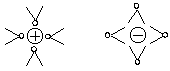
Wasserdipole umgeben in oktaedrischer Symmetrie die Ionen von NaCl.
(Die zwei unterhalb und oberhalb der Zeichenebene angeordneten Wasserdipole muss man sich dazu denken.)
Dabei sind die Ion/Dipol-Kräfte zwischen den Teilchen erstaunlich stark. Das führt zu einer dichteren Packung der Wassermoleküle, verglichen mit der des reinen Wassers. Hinzu kommen noch die dicht eingepackten Ionen. (Hier hat der Begriff der „Dichte“ einen auch für Schüler einsichtigen realen Hintergrund...) Folglich nimmt beim Lösen die Dichte des Wassers von 1,0 auf 1,2 g/mL (20 °C) zu. Das kann man in einem Versuch zeigen. Aber auch ein Ei schwimmt plötzlich, wenn man Salz ins Wasser rührt. Im Toten Meer gelingt es kaum jemanden unterzugehen.

Daggi im Toten Meer in Jordanien (Foto: Susanne Hoffmann)
Wie viel Salz löst sich im Wasser?
Das ist bei Kochsalz nur in Grenzen eine Frage der Temperatur. Eine gesättigte Lösung ist bei Zimmer-Temperatur
26%ig. Das entspricht 359 g/L (20 °C).
Bemerkenswert ist, dass dann schon fast die maximale Konzentration von Kochsalz in Lösung (391 g/L bei 100 °C) erreicht ist. Denn anders als „normale“ Salze wie zum Beispiel Kaliumnitrat, Ammoniumnitrat oder Ammoniumchlorid nimmt die Löslichkeit von Kochsalz nach 30 °C kaum noch zu.
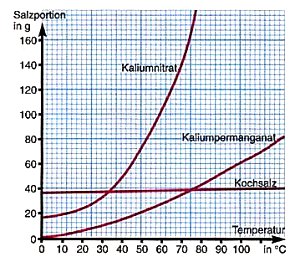
Temperaturabhängigkeit der Löslichkeit einiger Salze in 100 ml Wasser
(Quelle: Cornelsen)
Warum der Lösungsvorgang von Salz durch Erwärmen gefördert wird
Die Wassermoleküle bewegen sich schneller, außerdem schwingen die Teilchen des Kristallgitters heftiger.
Dadurch kann die Gitterenergie, also die Wechselwirkung zwischen den Kristallbauteilen, die den Kristall zusammenhält,
schneller überwunden werden.
Hinzu kommt, dass durch das Erwärmen auch die Lösungsumgebung des Kristalls turbulenter wird. Die von den Wassermolekülen eingehüllten Kristallbausteine können leichter wegwandern und machen so die Kristalloberfläche für weitere Angriffe der noch nicht gebundenen Wassermoleküle frei.
Das dauert so lange, bis der gesamte Kristall gelöst ist. Wenn allerdings nicht genügend Wassermoleküle vorhanden sind, bleibt ein ungelöster Bodensatz zurück. Wir sprechen dann von einer gesättigten Lösung.
Es ist aber falsch anzunehmen, dass in dieser Lösung nichts mehr passiert! Könnten wir zuschauen, so würden wir an der Oberfläche des Festkörpers ein ständiges Kommen und Gehen von Ionen beobachten. Dabei löst sich genau so viel Salz wie sich wieder zurückbildet. Man sagt, dass hier ein dynamisches chemisches Gleichgewicht vorliegt.
Dieses Gleichgewicht hängt besonders von der Temperatur ab. Erhitzt man eine Salzlösung mit Bodensatz, also eine gesättigte Lösung, so löst sich das feste Salz mehr oder weniger auf. Kühlt man die so erhaltene Lösung wieder ab, so entsteht eine übersättigte Lösung; der Bodensatz bildet sich wieder zurück.
Was thermodynamisch dahintersteckt
Ein wichtiger Aspekt beim Lösen ist, wie sich der Ordnungszustand des Systems verändert.
Dazu muss man den Verlust an Ordnung des Kristalls vergleichen mit der Zunahme der Ordnung der Wassermoleküle.
Letztere konnten sich vorher eher frei bewegen. Das war ein Zustand hoher Unordnung. Beim Kristall ist das umgekehrt:
Beim Lösen wird die hohe Ordnung des Kristallgitters zerstört.
Jedoch bilden sich ja bei der Bindung von Wassermolekülen an die Kristallbausteine neue, wohldefinierte
Molekül-Aggregate - es entsteht also wieder ein Zustand höherer Ordnung, so dass die Lösungsvorgänge energetisch
begünstigt ablaufen können. Das Stichwort lautet „Freie Energie“.
Weitere Texte zum Thema „Salz“