Die Reaktion zwischen Natrium und Chlor
Experimente:
Klicke hier
Leitet man Chlorgas über geschmolzenes Natrium, so reagieren beide Stoffe heftig unter
Flammenerscheinung miteinander. Es entsteht ein weißes, kristallines Pulver, Natriumchlorid NaCl,
bekannt als Kochsalz:
Na + ½ Cl2 ———> Na+ + Cl¯ + Energie
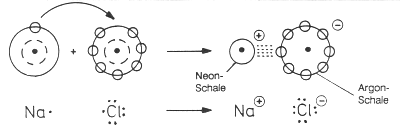
Im Verlauf der Reaktion übertragen Natriumatome je ein Elektron auf die Chloratome. Es entstehen positiv geladene Natrium-Ionen und negativ geladene Chlorid-Ionen.

Bildung von Kochsalz aus Natrium und Chlor
Warum wird bei dieser Reaktion nur ein Elektron übertragen? Die Elemente streben an, die Elektronenkonfiguration der am nächsten gelegenen Edelgasschale zu erreichen. Diese ist energetisch besonders stabil (wie die geringe Reaktivität der Edelgase zeigt).
Das sehr reaktive Metall Natrium hat ein Valenzelektron, das sehr reaktive Chlor sieben. Dagegen haben die gebildeten Ionen vollbesetzte Schalen mit jeweils acht Valenzelektronen: Das Na+-Ion hat die Edelgasschale von Neon, das Cl¯-Ion die von Argon. Analog zu den wenig reaktiven Edelgasen sind deshalb auch die Natrium- und Chlorid-Ionen sehr stabil, nicht mehr reaktiv und nicht so giftig wie die Elemente.
Die Ionen lagern sich aufgrund ihrer elektrostatischen Anziehung zu einem Ionengitter zusammen. So entsteht der berühmte würfelförmige Kochsalz-Kristall.
Weitere Texte zum Thema „Salz“