 |
 |
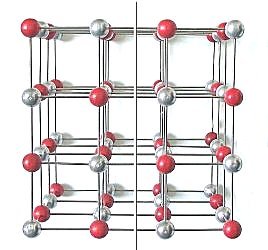
| Modell zur Erklärung der Spaltung eines
Kochsalzkristalls längs seiner Würfelflächen.
Silberne Kugeln: Na-Ionen, rote Kugeln: Chlorid-Ionen (Grafik: Blume) |
Zum Spalten von Kochsalzkristallen
Experimente:
Klicke hier
Anhand des Aufbaus des Ionengitters von Kochsalz lässt
sich erklären, warum Salzkristalle so ausgesprochen spröde sind. Schlägt man zum Beispiel mit einem
kleinen Hammer leicht auf die Mitte einer der Würfelflächen eines größeren Kochsalzkristalls,
so entstehen viele kleine Würfel.
Beim Schlag werden die Ionenschichten des Kristalls kurzfristig verschoben. Wie sich das auswirkt, kann man ebenfalls am Besten mit dreidimensionalen Modellen zeigen. Dazu blickt man senkrecht auf eine Würfelfläche, so wie wir es auf unseren folgenden Grafiken zeigen.
Die Würfelflächen von Natriumchlorid enthalten in alle Richtungen alternierend positiv geladene Natrium-Ionen und negativ geladene Chlorid-Ionen. Nach dem Schlag stehen sich kurzfristig längs der Verschiebungsschicht alle gleichsinnig geladenen Ionen gegenüber. Das zeigt das folgende Bild.
 |
 |
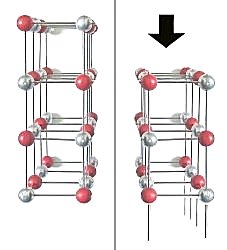
| Modell zur Erklärung der Spaltung eines
Kochsalzkristalls längs seiner Würfelflächen.
Silberne Kugeln: Na-Ionen, rote Kugeln: Chlorid-Ionen (Grafik: Blume) |
Die Folge ist die gegenseitige elektrostatische Abstoßung der Ionen und die explosionsartige Auftrennung
des Gitters. Es entstehen Spaltwürfel und -quader.
Länger anhaltender, starker Druck jedoch kann sehr wohl zur Deformation führen. Dann verhalten sich Salze regelrecht plastisch. So entstanden zum Beispiel die Salzstöcke. Bei denen kann man auch heute noch die weiterhin ablaufende Deformierung beobachten. Sie gefährdet nicht nur die Arbeiter in den Salzbergwerken, sondern ist auch die Ursache für die anhaltende Diskussion zur Sicherheit von Salzbergwerken als Endlager für Nuklearabfälle oder chemische Gefahrstoffe.
Weitere Texte zum Thema „Salz“