Amphoter - Mal Säure, mal Base
Amphoter nennt man die Eigenschaft von Stoffen, sowohl Akzeptor als auch Donator für Protonen zu sein. Amphotere Stoffe, die Ampholyte, verhalten sich demnach gegenüber stärkeren Säuren wie Basen, gegenüber stärkeren Basen wie Säuren. Das Wort Amphoter stammt vom griech. amphoteros, beiderlei, ab.
Ammoniak ist ebenso wie Wasser amphoter
Wasser kann je nach dem gegebenen Milieu als Säure oder Base reagieren. Gibt man zum Beispiel
Salzsäure (HCl) in Wasser, so reagiert das Wasser im Sinne des Säure/Base-Begriffs
nach Brönsted als Base:
H+ + Cl- + H2O ———> H3O+ + Cl-
Das Wassermolekül nimmt ein Proton auf und ist somit ein Protonen-Akzeptor bzw. eine Base.
In der Reaktion mit Ammoniak hingegen verhält sich Wasser als Säure:

Das Wassermolekül gibt ein Proton an das Ammoniakmolekül ab und ist deshalb ein Protonen-Donator bzw. eine Säure.
Das Ammoniakmolekül ist in diesem Fall der Protonen-Akzeptor. Es ist also eine Base.
Aber wie die Überschrift vermuten lässt, gibt es auch Reaktionen, bei denen Ammoniak als Säure auftritt. Das ist zum Beispiel bei der Reaktion mit einem H--Ion (Hydrid-Ion) der Fall.
H- + NH3 ———> H2 + NH2-
Hier gibt das Ammoniakmolekül ein Proton an das stark basische H--Ion ab und ist daher ein Protonen-Donator bzw. eine Säure.
Wann reagiert ein amphoterer Stoff als Base und wann als Säure?
Ob ein amphoterer Stoff als Säure oder als Base reagiert, hängt von seiner Säure-
bzw. Basenstärke ab. Die Säurestärke ist eine relative Größe für die Tendenz eines Stoffes, ein
Proton abzugeben und folglich als Säure zu reagieren. Die Basenstärke ist analog dazu eine relative Größe für
die Tendenz eines Stoffes ein Proton aufzunehmen und somit als Base zu reagieren.
Der Stoff mit der höchsten Säurestärke reagiert bei einer Säure/Base-Reaktion als Säure.
Der Stoff mit der niedrigsten Säurestärke reagiert bei einer Säure/Base-Reaktion als Base.
Ein Stoff wie Chlorwasserstoff (HCl) hat eine höhere Säurestärke als Wasser. Also reagiert HCl in der Reaktion mit Wasser als Säure und Wasser als Base.
HCl + H2O ———> H3O+ + Cl-
Da das Chlorid-Ion eine äußerst schwache Base ist, findet keine Rückreaktion statt.
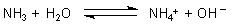
Die Säurestärke von Wasser ist aber größer als die des Ammoniaks. Somit reagiert das Wassermolekül in der Reaktion mit Ammoniak als Säure und Ammoniak als Base.
Ammoniak ist eine nur wenig schwächere Base als Wasser, deshalb kann es sein Proton auch wieder auf Wasser rückübertragen. Wir müssen die Reaktionsgleichung deshalb als chemisches Gleichgewicht formulieren.
Je stärker eine Säure, desto schwächer ist ihre konjugierte Base.
Je stärker eine Base, desto schwächer ist ihre konjugierte Säure.
Weitere Ampholyte finden wir bei den Aminosäuren. Aber auch die Aluminium-Aquo-Komplexe gehören zu diesen Stoffen.
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“