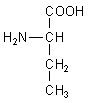
Aminosäuren - Die lebensnotwendigen Säuren
Experimente:
Versuch: Nachweis von Aminosäuren: Die
Ninhydrin-Reaktion
Als Aminosäuren bezeichnet man Carbonsäuren, die eine oder mehrere Aminogruppen
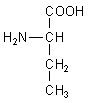
α-Aminobuttersäure (2-Aminobuttersäure)
Die für den Menschen wichtigen Aminosäuren
Wichtig für alles Leben sind die α-Aminosäuren, da sie als Bausteine für
Peptide und Proteine benötigt werden. Zu ihnen werden etwa 20 Aminosäuren gezählt. Hinzu
kommen noch spezielle Aminosäuren, die in Stoffwechselwegen wie dem Harnstoffzyklus eine
Rolle spielen.
| Klick mich an! |
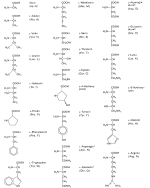 |
| Die wichtigsten Aminosäuren und ihre Abkürzungen |
Folgende acht Aminosäuren können vom menschlichen Organismus nicht selbst synthetisiert werden,
weil ihm die entsprechenden Enzyme fehlen.
| Verzweigte Aminosäuren: | Valin, Leucin, Isoleucin, |
| Aromatische Aminosäuren: | Phenylalanin, Tryptophan, |
| Weitere Aminosäuren: | Lysin, Threonin, Methionin |
Man nennt sie essentielle Aminosäuren. Da diese Aminosäuren jedoch für den Aufbau von körpereigenen Peptiden und Proteinen benötigt werden, bleibt dem Menschen nichts anderes übrig, als diese Aminosäuren mit der Nahrung aufzunehmen.
Alle Aminosäuren weisen eine ähnliche Grundstruktur auf
An den C-Atomen 1 und 2 sind alle Aminosäuren identisch (ausgenommen: Prolin). Lediglich der Rest -R,
der auch als Seitenkette bezeichnet wird, kann variieren. Die Seitenketten unterscheiden sich in
ihrer Säure-Base-Eigenschaft, ihrer Polarität und ihrer Ladung. Die folgende Übersicht fasst die Gruppen zusammen.
Manche Aminosäuren (abgekürzt: AS) tauchen mehrmals auf. So ist Histidin zugleich basisch, heterozyklisch und dazu
auch noch eine aromatische Verbindung. Glycin, das gar keinen Rest trägt, zählt man dennoch zu den aliphatischen AS.
Saure AS: Asparaginsäure, Glutaminsäure
Säureamid-AS: Asparagin, Glutamin
Basische AS: Lysin, Arginin, Histidin, Prolin
Heterocyclische AS: Tryptophan, Histidin, Prolin
Aliphatische AS: (Glycin), Alanin, Valin, Leucin, Isoleucin
Aromatische AS: Phenylalanin, Tyrosin, Tryptophan, Histidin
Alkoholische AS: Serin, Threonin, Tyrosin
Schwefelhaltige AS: Cystein, Methionin
Aminosäuren sind optisch aktiv
Trägt ein C-Atom vier verschiedene Atomgruppen, so handelt es sich um ein asymmetrisches C-Atom
(C*). Dadurch bekommt ein Molekül eine neue Eigenschaft, nämlich eine Chiralität. Das Molekül
kann dann in zwei verschiedenen Raumstrukturen - den optischen Isomeren - angeordnet sein, die
man nicht zur Deckung bringen kann. Sie verhalten sich wie ein Bild zu seinem Spiegelbild oder wie die rechte
Hand zur linken. Gekennzeichnet wird das durch ein großes D (von lateinisch: dexter) oder L (von lateinisch:
laevus). Bezogen auf Aminosäuren gibt es also D- und L-Aminosäuren, wie z. B. D- und L-Alanin. Als Bausteine
von Proteinen findet man interessanterweise nur L-Aminosäuren.
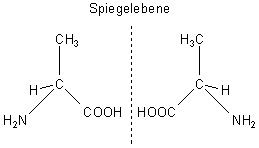
Raumstrukturen der Aminosäure Alanin
Optische Isomere weisen die gleichen chemischen Eigenschaften auf, verhalten sich aber gegenüber polarisiertem Licht unterschiedlich. Die eine Molekülsorte dreht die Schwingungsebene des polarisierten Lichts nach rechts (+), die andere um den gleichen Betrag nach links (-). Man bezeichnet das Phänomen als optische Aktivität, die man in speziellen Geräten, den Polarimetern, messen kann. Eine optische Aktivität findet man bei vielen anderen Substanzklassen auch, so z. B. bei den Zuckern oder auch bei der Milchsäure.
Aminosäuren sind Ampholyte
Da die meisten Aminosäuren durch die Carboxylgruppe einen sauren und durch die Aminogruppe einen basischen Teil
im Molekül enthalten, sind sie Ampholyte. Dabei reagieren Säure und Base intramolekular. Das heißt,
sie bilden in wässriger Lösung Zwitter-Ionen. Der pH-Wert, bei dem das Gleichgewicht aus
Zwitter-Ion und undissoziierter Aminosäure vorliegt, bezeichnet man als Isoelektrischen Punkt.
Hierauf gehen wir ganz besonders bei der Besprechung der einfachsten Aminosäure Glycin
ein.
Chemische Nachweise von a-Aminosäuren
a-Aminosäuren lassen sich auch mit Hilfe der Ninhydrin-Reaktion
nachweisen. Erwärmt man eine Protein-Probe mit Ninhydrin-Lösung, kommt es zu einer Blauviolettfärbung. Der Nachweis mit
Ninhydrin wird bei der Dünnschicht-Chromatographie zum Nachweis kleinster Aminosäuremengen
verwendet. Eine weitere Anwendung der Ninhydrin-Reaktion finden Sie hier.
Zum Nachweis der aromatischen Aminosäuren, wie z. B. Tryptophan oder Tyrosin, versetzt
man eine Protein-Probe mit konzentrierter Salpetersäure. Es tritt eine Gelbfärbung auf, die bei dieser
Xanthoprotein-Reaktion (griech. xanthos, gelb) auf die Nitrierung
des Benzolkernes zurückzuführen ist.
Diese Gelbfärbung ist übrigens auch der Grund dafür, dass man bei unachtsamem Arbeiten mit Salpetersäure oder sogar auch mit Stickoxiden gelbe Flecken auf der Haut bekommt.
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“