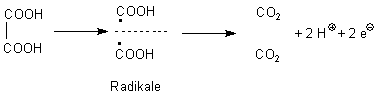
Reduzierende Eigenschaften des Oxalsäuresystems
Experimente
Versuch: Oxalsäure als Reduktionsmittel
Versuch: Bestimmung einer unbekannten Oxalsäurekonzentration mit
Kaliumpermanganat
Eine der hervorstechenden Eigenschaften der Oxalsäure ist ihre Reduktionswirkung. Darauf
beruhen nicht nur einige Nachweisreaktionen, sondern auch viele
ihrer technischen Verwendungen, so zum Beispiel als Bleichmittel
oder in der Analytik (Oximetrie; insbesondere bei der Manganometrie).
Die Oxidation der Oxalsäure
Das Molekül der Oxalsäure hat sozusagen eine Sollbruchstelle zwischen den beiden C-Atomen.
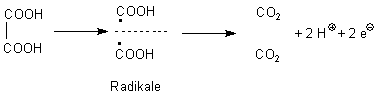
Bei der Spaltung ändert sich die Oxidationszahl der C-Atome von (+III) nach (+IV). Somit ist die Oxalsäure ein Reduktionsmittel.
Oxidation: HCOOC-COOH ———> 2 CO2 + 2 H+ + 2 e- E0 = -0,49 V
Das gleiche gilt für die Salze der Oxalsäure, die Oxalate.
Es gibt eine Reihe von Oxidationsmitteln für die Oxalsäure
Am meisten wird Kaliumpermanganat verwendet.
Reduktion: MnO4- + 8 H+ + 5 e- ———> Mn2+ + 4 H2O
Ähnlich verläuft die Reaktion mit Chromat und Dichromat.
Reduktion: CrO42- + 8 H+ + 3 e- ———> Cr3+ + 4 H2O
Hexacyanoferrat(III) (Rotes Blutlaugensalz) wird unter Lichteinwirkung zu Hexacyanoferrat(II) reduziert.
Reduktion: [Fe(CN)6]3- + e- ———> [Fe(CN)6]4-
Mit ammoniakalischer Silbernitratlösung bildet sich ein schwarzer Niederschlag von Silber.
Reduktion: Ag+ + e- ———> Ag
Die bekannte Fehling-Reaktion mit Kupfer(II) als Oxidationsmittel ist jedoch negativ.
Weitere Texte zum Thema "Oxalsäure"