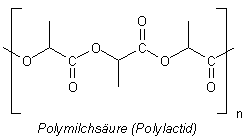
Der spezielle Polyester: Polymilchsäure
Experimente:
Versuch: Synthese von Polymilchsäure
Ein Kunststoff, der in den dreißiger Jahren entdeckt wurde, macht mittlerweile
Furore. Selbst Kosmetiker unterspritzen damit Fältchen und machen Damenhaut wieder glatt.
Der Kunststoff ist außerdem biologisch abbaubar.

Es handelt sich um die Polymilchsäure oder um das Polylactid (auch Polylactat; PLA).
Dieser Kunststoff gehört zur Gruppe der Polyester. Bei der Polyesterbildung denkt man
sofort an die Polykondensation.
Bei den bisherigen Polykondensaten hatten wir es mit zwei verschiedenen Monomeren zu
tun: mit einer bifunktionellen Säure (wie der Terephthalsäure bzw. derem Säurechlorid)
und einem bifunktionellen Alkohol (wie dem Glykol). Zwischen Säuregruppe und Alkoholgruppe
wird die Esterbindung geknüpft - unter Abgabe kleiner Moleküle wie Wasser oder HCl.
Milchsäure als bifunktionelles Monomer
Zum Aufbau eines Polyesters aus Milchsäure benötigen wir nur ein einziges Monomer.
Die Milchsäure trägt jeweils eine OH-Gruppe und eine COOH-Gruppe. (Von der Milchsäure gibt es zwei
Enantiomere, was hier aber nicht von großer Bedeutung ist.)
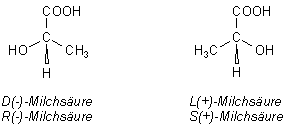
Zur Veresterung wird die Hydroxylgruppe eines Milchsäuremoleküls mit der Carboxylgruppe eines zweiten Milchsäuremoleküls verbunden. So sollten lange Molekülketten entstehen. Aber der Mechanismus ist etwas komplizierter.
Milchsäure liegt nicht frei vor
Milchsäure bildet Dimere, die so genannten Dilactide. Das sind cyclische
Ester.
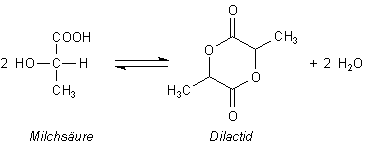
Bei der Milchsäure erfolgt sie zwischen zwei (oder mehr) Molekülen spontan, so dass es in konzentrierteren Lösungen kaum einzelne, offenkettige Milchsäuremoleküle gibt. Diese primäre cyclisierende Esterbildung verläuft wie üblich unter Wasserabspaltung (Kondensation). Solche inneren, cyclischen Ester heißen Lactone. Da steckt schon das lateinische Wort für Milch (lac, lactis) drin.
Dieses dimere Lactid ist übrigens ein g-Lactid. Es kann sich unter gewissen Bedingungen auch ein intramolekulares, kleinringiges a-Lactid bilden. Zu den Lactiden und Lactonen, die auch bei der Chemie des Phenolphthaleins eine zentrale Rolle spielen, haben wir eine Webseite.
Ein anderes Beispiel für ein solches Lacton ist die Ascorbinsäure (Vitamin C).
Wie die Polylactide synthetisiert werden
Die Bildung des Polyesters (Polylactat) verläuft somit nicht ausgehend von der freien, monomolekularen
Hydroxysäure als Monomer, sondern von den Dilactiden. Diese dimeren Lactone reagieren beim Erhitzen
miteinander, wobei die Ringe geöffnet werden. Man spricht von Ringöffnungspolymerisation.
Diesen Reaktionstyp gibt es auch bei der Perlonsynthese.
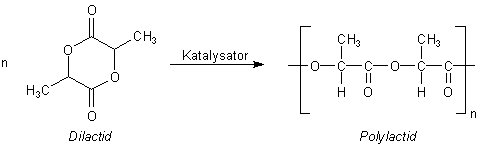
Die Reaktion wird durch verschiedene Metallsalze katalysiert. Ein Beispiel ist das Zinn(II)-chlorid, ein typischer Lewis-Säure-Katalysator. Er bewirkt durch Komplexbildung, dass Bindungen wie C=O, an die das O-Atom der Esterbindung angreift, stärker polarisiert werden.
Milchsäure - ein nachwachsender Rohstoff?
Milchsäure kann sowohl technisch wie auch mikrobiologisch hergestellt werden. Da die biologische Quelle
leicht zugänglich ist, handelt es sich bei der Milchsäure um einen typischen nachwachsenden
Rohstoff.
Wofür man Polylactid einsetzt
Polylactid wird natürlich nicht nur zum Unterfüttern von Falten genutzt. Es hat auch eine weite
Anwendung in der Technik gefunden. Besonders hoch wird seine Verwendung als biologisch abbaubares
Verpackungsmaterial eingeschätzt, wobei es Polystyrol und andere petrostämmige Materialien ersetzen
kann. Aber auch "Biofasern" sollen sich daraus herstellen lassen. Wichtig ist, dass der Stoff
biokompatibel ist, also sich mit der Haut und dem sonstigen menschlichen Gewebe verträgt.
Deshalb wird Polymilchsäure auch in der Medizin verwendet.
Hinzu kommt, dass man wegen der asymmetrischen C-Atome in der Kette auch sterische Isomere schaffen
kann, mit deren Hilfe sich maßgeschneiderte PLA-Moleküle herstellen lassen.
Zur zeitlich gezielten Zersetzung von Polymilchsäure
Polymilchsäure-Fäden werden zum Vernähen von Wunden verwendet. Diese Fäden müssen sich nach gewisser
Zeit von alleine auflösen. Diese Zeit kann man durch einen Trick steuern.
Die gleichen Reaktionen (Cyclisierung und Polymerisation) zeigt auch die Glykolsäure.
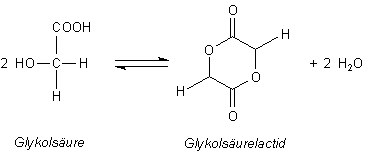
Glykolsäurelactid bildet die Polyglykolsäure (PGA).
Zum Abbau im Gewebe (Biodegradation): Es handelt sich vor allem um eine spontane Reaktion, die zwar säurekatalysiert ist, aber auch schon im pH-Milieu der Zellen und des Gewebes abläuft. Reines PLA wird rasch abgebaut, reine PGA kaum. Deshalb kann man durch Copolymerisation von Milchsäure- und Glykolsäurelactid den zeitlichen Ablauf des Abbaus des Polyesters im Gewebe steuern, indem man die Mischungsverhältnisse der beiden Säuren bzw. ihrer Lactone entsprechend einstellt.
Weitere Texte zum Thema „Kunststoffe“