Das Phenolphthalein-Molekül genauer betrachtet
Experimente:
Klicke hier
Unsere Versuche mit Phenolphthalein, die sich mit dem Verhalten gegenüber
Säuren, Basen und Salzen befassen, haben folgende Ergebnisse ergeben:
In stark saurem Milieu ist Phenolphthalein erdbeerrot, im schwach Sauren und Neutralen farblos, in schwach alkalischem Milieu purpurrot. Im stark Alkalischen wird die purpurne Lösung langsam wieder farblos.
Um diese Farbwechsel zu erklären, müssen wir zunächst die funktionellen Gruppen des Phenolphthalein-Moleküls genauer betrachten: Das zentrale Kohlenstoffatom, den innermolekularen Ester, die Benzolringe sowie die phenolischen Hydroxylgruppen bzw. Chinone.

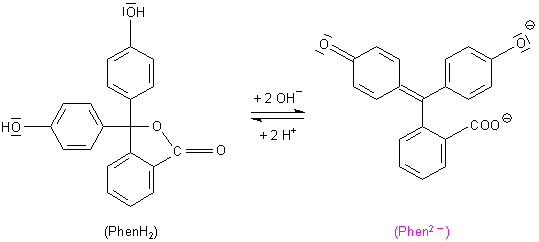
Die beiden für die Indikatorfunktion wichtigsten Strukturen des Phenolphthalein-Moleküls
1. Das zentrale C-Atom
Das zentrale C-Atom erinnert uns daran, dass Phenolphthalein zu den Triphenylmethanfarbstoffen
gehört. Je nach seinen Bindungszuständen steuert das zentrale C-Atom die Planarität des Phenolphthalein-Moleküls:
| - | Trägt es vier Substituenten, sind seine Bindungen wegen der sp3-Hybridisierung tetraedrisch angeordnet; das Molekül ist nicht planar. |
| - | Trägt es nur drei Substituenten, so sind seine Bindungen sp2-hybridisiert und trigonal angeordnet; sie liegen in einer Ebene und das Molekül ist planar. |
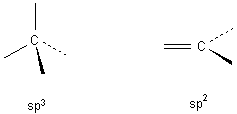
Farbige Moleküle müssen zumindest in einigen Bereichen planar sein, denn nur sie gestatten die Bildung mesomerer Grenzzustände.
2. Der innermolekulare Ester
Phenolphthalein besitzt als Strukturmerkmal einen innermolekularen Ester. Den entsprechenden
Ester von Hydroxycarbonsäuren bezeichnet man als Lacton. Lactone bilden einen Ring, der in
schwach saurem und neutralem Milieu geschlossen ist. Das namensgebende Lacton ist wohl das der Milchsäure,
welches allerdings nur in Lösung stabil ist (latein. lac, lactis, Milch). Man spricht von einem
a-Lacton. Wesentlich stabiler ist das weitringige g-Lacton,
das wir bei der Ascorbinsäure kennenlernen. Aber auch das Lacton des
Phenolphthaleins ist ein g-Lacton.
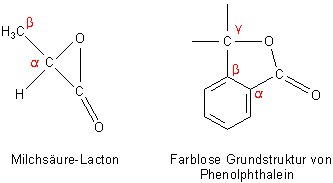
Diese Ringbildung erfolgt beim Phenolphthalein wie bei der Milchsäure spontan. Sie ist reversibel. (Bei der Milchsäure gibt es noch das stabilere cyclische Dilactid, ein Ester aus zwei Milchsäuremolekülen. Er spielt eine wichtige Rolle zur Synthese von Polymilchsäure.)
Bemerkenswert ist, dass die Lactonbildung beim Phenolphthalein keine Kondensationsreaktion ist, sondern ohne jegliche Wasserabspaltung abläuft. Sie ist eine Additionsreaktion. Dabei wird die Carboxylgruppe durch das in engster Nachbarschaft liegende zentrale sp2-C-Atom angegriffen. Es stellt sich auch hier wie bei allen Estern ein chemisches Gleichgewicht zwischen Esterbildung und Esterspaltung ein.
Im Alkalischen bleibt der Ring zunehmend geöffnet, weil sich dann die chinoiden Strukturen ausbilden. Das entspricht der fortschreitenden alkalischen Hydrolyse von Estern, etwa wie bei der Verseifung von Fetten.
3. Die Benzolringe und die phenolischen Gruppen
Die beiden phenolischen Benzolringe können – wenn das Molekül planar ist - über das zentrale sp2-C-Atom
hinweg wechselwirken. Es bilden sich mesomere Grundzustände aus, die als Ursache der Absorption von elektromagnetischer
Strahlung anzusehen sind. Die Substituenten nehmen dabei an der Mesomerie „ihres“ Aromaten teil. Man spricht von einem
(+M)-Effekt. Die Mesomerie führt zu chinoiden Grenzstrukturen, bekannt nach dem 1,4-Benzochinon.
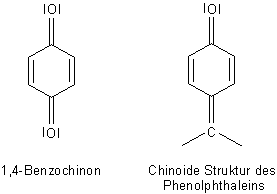
Da Phenole Säuren sind und in alkalischem Milieu ihre Protonen abgeben können, wird ihr Elektronensystem noch
leichter anregbar. Deshalb absorbieren Phenole langwelliger als die zugrunde liegenden Aromaten; Phenolat-Anionen
absorbieren noch langwelliger als die zugrunde liegenden Phenole. Die Absorption von elektromagnetischer
Strahlung verschiebt sich wegen der negativen Überschussladung vom unsichtbaren UV in Richtung auf den sichtbaren
Teil des Spektrums (VIS). Der Stoff wird für uns irgendwann mal farbig.
Der dritte aromatische Ring, der die Carboxylgruppe trägt, ist kein Teil des farbgebenden Mesomeriesystems.
In den folgenden Webseiten erklären wir die einzelnen Reaktionen:
Das Phenolphthalein-Molekül in stark saurem pH-Milieu
Das Phenolphthalein-Molekül in schwach saurem bis neutralem Milieu
Das Phenolphthalein-Molekül in schwach alkalischem Milieu
Das Phenolphthalein-Molekül in stark alkalischem Milieu
Weitere Texte zum Phenolphthalein