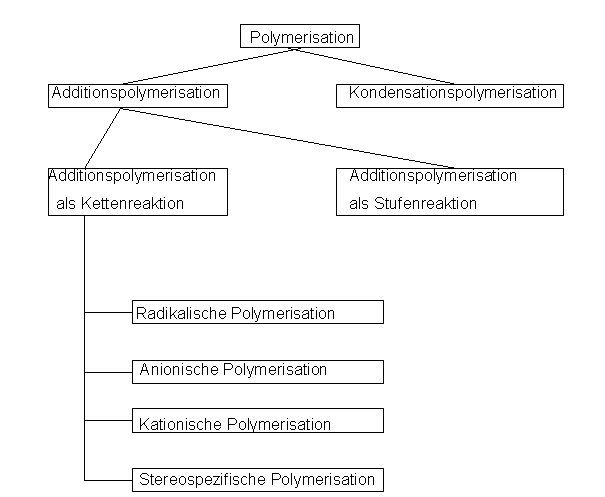
Übersicht über die verschiedenen Polymerisationsarten
Inhalt:
1. Polymerisation
1.1.1 Additionsreaktion als Kettenreaktion
1.1.1.1 Radikalische Polymerisation
1.1.1.2 Anionische Polymerisation
1.1.1.3 Kationische Polymerisation
1.1.1.4 Stereospezifische Polymerisation
1.1.2 Additionsreaktion als Stufenreaktion
1.2 Kondensationspolymerisation
1. Polymerisation
Unter Polymerisation versteht man die Überführung von niedermolekularen Verbindungen (Monomeren) zu
hochmolekularen Verbindungen (Polymeren).
Die chemische Reaktion zwischen den einzelnen Bausteinen eines Polymers kann je nach chemischer Eigenart
der eingesetzten Monomere auf unterschiedliche Art und Weise verlaufen:

1.1 Additionspolymerisation
Bei der Additionspolymerisation reagieren Monomere miteinander, ohne dass bei der Reaktion ein anderes Molekül
abgespalten wird. Als Monomere kommen dabei Chemikalien in Betracht, die in sich eine weitere Bindungsmöglichkeit,
z. B. in Form einer Doppelbindung aufweisen.
1.1.1 Additionspolymerisation als Kettenreaktion
Läuft eine Additionsreaktion nach dem Schema einer Kettenreaktion ab, bedeutet das,
dass eine Reaktion zwischen den Monomeren erst einmal gestartet werden muss, dann jedoch von alleine weiterreagiert,
bis alle Monomere zu Polymeren miteinander verknüpft sind oder eine Abbruchreaktion eintritt. Man spricht von einer
linearen, also unverzweigten Kettenreaktion. Bei dieser chemischen Reaktion wird noch weiter unterschieden,
auf welche Art und Weise die Reaktion gestartet wird.
1.1.1.1 Radikalische Polymerisation
Beispiel ist die Polymerisation von Styrol zu Polystyrol. Als Starter der Kettenreaktion dient Benzoylperoxid.
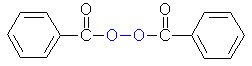
(1a)
Im ersten Schritt wird das Peroxid so gespalten, dass beide Sauerstoffatome jeweils ein Elektron des Bindungselektronenpaares
bekommen. Die dabei entstehenden Moleküle sind wegen ihrer ungepaarten Elektronen sehr reaktiv und heißen daher
Radikale.
Dieses Benzoylperoxid-Radikal ist allerdings nicht stabil und zerfällt unter Abgabe von Kohlenstoffdioxid in ein anderes Radikal, das Phenyl-Radikal.
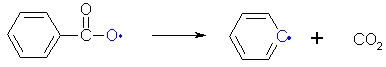
(1b)
Anschließend reagiert das Phenyl-Radikal mit einem Styrolmolekül.
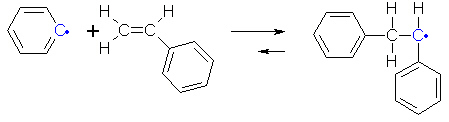
(1c)
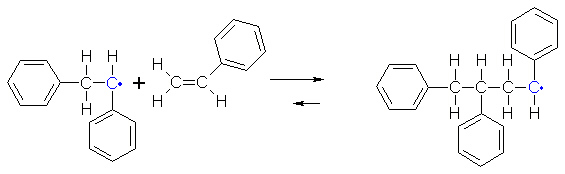
Es entsteht ein neues Radikal, das sich mit einem weiteren Styrolmolekül verbindet. Das um ein Styrolmolekül verlängerte
Radikal reagiert erneut mit einem Styrolmolekül - und so weiter. Auf diese Art und Weise kommt es zum Aufbau eines
langkettigen Polymermoleküls aus Styrol, dem Polystyrol.
(1d)
Die Reaktion hört auf, wenn alle Monomere verbraucht sind. Oder zwei Radikale treffen aufeinander und dimerisieren. Denn
dann bilden die zwei einzelnen Elektronen ein Bindungselektronenpaar.
1.1.1.2 Anionische Polymerisation
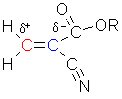
Bei der anionischen Polymerisation bilden die Monomere eine wachsende Anionenkette. Diese Reaktion soll anhand
des Cyanoacrylats, das im Sekundenkleber enthalten ist, erklärt werden.
(2a)
R steht für eine Methyl- oder Ethylgruppe.
Im Cyanoacrylatmolekül ist die Ethylen-Doppelbindung aufgrund des Elektronenzugs durch die Ester- und Nitrilgruppe stark polarisiert.
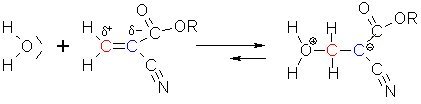
Am positiven linken Ende der Ethylenbindung kann ein Wassermolekül (z. B. aus der Luft) andocken. In der Folge klappt das Elektronenpaar zum rechten C-Atom, das dadurch eine negative Ladung bekommt.
(2b)
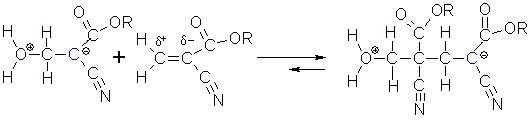
An diese negative Ladung koppelt jetzt ein anderes Cyanoacrylatmolekül an.
(2c)
Diese Kettenreaktion ist beendet, wenn alle Monomere verbraucht sind. Die beiden Ladungen der Polymerkette gleichen sich durch
Protonenaustausch aus.
1.1.1.3 Kationische Polymerisation
Bei der kationischen Polymerisation bilden die Monomere eine wachsende Kationenkette. Diese Reaktion soll anhand der
Polymerisation von Styrol dargestellt werden.
Zu Beginn der Reaktion lagert sich ein Proton (z. B. aus zugefügter Schwefelsäure) an das linke Kohlenstoffatom an. Da zur Bindung ein Elektronenpaar benötigt wird, klappt ein Elektronenpaar der Doppelbindung des Styrols zum H+-Ion und verbindet es mit dem roten Kohlenstoffatom. Am rechten Kohlenstoffatom fehlt jetzt ein Elektron; es ist daher positiv geladen.
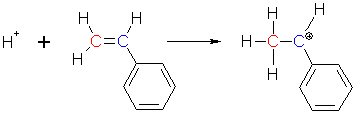
(3a)
Dieses Kation vermag wieder ein Styrolmolekül zu binden - und so weiter.
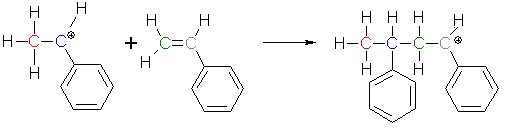
(3b)
Die Polymerisation schreitet voran, bis entweder die Monomere verbraucht sind oder das positiv geladene Ende eines Polymers auf
ein negatives Ion wie das HSO4--Ion trifft, das bei der Dissoziation der Schwefelsäure entstanden ist.
1.1.1.4 Stereospezifische Polymerisation
Die bislang besprochenen Polymerisationsarten führen zu Molekülen, bei denen die Reste der verknüpften Monomere völlig ungeordnete
Richtungen einnehmen. Dagegen werden bei der stereospezifischen Polymerisation Alkene in einer bestimmten sterischen Anordnung
mittels einer katalytisch wirksamen Komplexverbindung verknüpft. Diese Polymerisation soll anhand der Bildung von Polypropen
(Polypropylen) erklärt werden.
Das monomere Propenmolekül enthält eine Doppelbindung und an einem Kohlenstoffatom der Doppelbindung eine CH3-Gruppe.
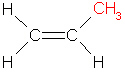
(4a)
Durch die CH3-Gruppe ergeben sich verschiedene Möglichkeiten von Polypropenstrukturen. Diese beeinflussen die
Eigenschaften des Polymers ganz außerordentlich. Optimale mechanische Eigenschaften weisen Makromoleküle auf, deren CH3-Gruppen
in einer möglichst regelmäßigen Anordnung vorliegen. Die folgende Anordnung, die dafür am Besten geeignet ist, wird als
isotaktisch bezeichnet. Bei der liegen die Methylgruppen auf einer Seite und sind regelmäßig angeordnet.
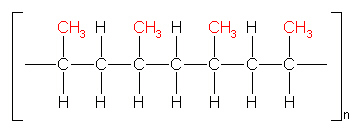
(4b)
Um die Polypropenmoleküle so zu verbinden, dass sie diese Anordnung erhalten, werden spezielle Katalysatoren
(Ziegler-Natta-Katalysatoren) benutzt. Dies sind selbst Polymere, allerdings
auf anorganischer Basis. Durch deren sterisch gezielt aufgebaute Form ist gewährleistet, dass ein Propenmolekül
immer "richtig" herum an das Ende der Polypropenkette gebunden wird. (Hier ist durchaus ein Vergleich mit den katalytisch
wirksamen „aktiven Zentren“ von Enzymen erlaubt.)
Zunächst lagert der Katalysator ein Propenmolekül in sein aktives Zentrum ein. X und Y bedeuten Bindungsstellen des komplexen Katalysatormoleküls.
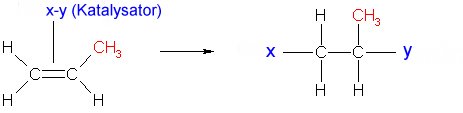
(4c)
Dadurch kommt es außerdem zur Polarisation des Propenmoleküls. Dann lagert sich wieder ein Propenmolekül an. Dabei wird
es in die gewünschte Richtung gedreht und dann an das umfasste Molekül gebunden.
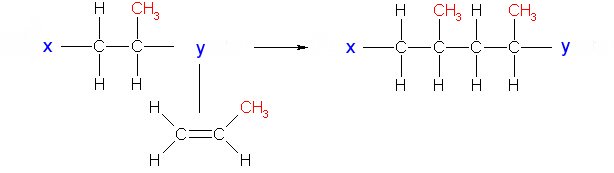
(4d)
1.1.2 Additionsreaktion als Stufenreaktion
Bei der Additionsreaktion reagieren unterschiedliche Monomere miteinander. Diese Art der Reaktion soll am Beispiel der Bildung von
Polyurethan erklärt werden.
Die Monomere der Polyurethane sind Diisocyanate und zweiwertige Alkohole (Diole).
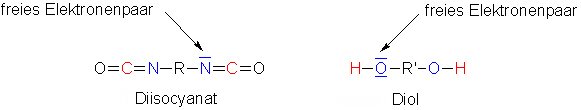
(5a)
Die mit R und R' bezeichneten Teile in den Molekülen sind unterschiedliche Bausteine aus der Kohlenstoffchemie.
Der Start der Reaktion erfolgt durch ein freies Elektronenpaar am O-Atom des Diols, das als Nucleophil das positiv polarisierte C-Atom des Isocyanats angreift. Dadurch wird das H-Atom der Hydroxylgruppe gelockert und als Proton vom gegenüberliegenden N-Atom übernommen.
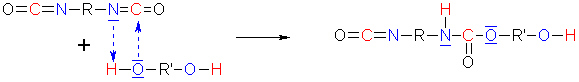
(5b)
Es bilden sich auf diese Weise ein Ester und zugleich ein Säureamid.
Das Molekül, das jetzt entstanden ist, ist zugleich ein Isocyanat und ein Alkohol. Es kann sich auf der einen Seite wieder mit einem Diol und auf der anderen Seite mit einem weiteren Isocyanat verbinden. Auf diese Art bildet sich eine lange Molekülkette.
Dazu können sich auch schon gebildete Ketten miteinander verknüpfen, da sie ja auch die passenden aktiven Endgruppen besitzen. Man spricht von einer Stufenreaktion.
Im Allgemeinen benötigt man zum Reaktionsstart bei Polyurethanen einen Aktivator. Hierbei handelt es sich um eine Base. Was bei dieser katalytischen Reaktion abläuft, erklären wir hier.
1.2 Kondensationspolymerisation
Unter Kondensation versteht man in der Chemie eine Reaktion, bei der sich zwei Stoffe unter Abgabe eines dritten verbinden. Letztere
sind im Allgemeinen erheblich kleiner als die reagierenden Stoffe.
Die Stoffe, die zur Reaktion gebracht werden, müssen jeder mindestens zwei funktionelle Gruppen besitzen, mit der sie Bindungen eingehen können.
Hier sei die Bildung eines Polyesters anhand des Beispiels der Glyptale dargestellt.
Diese werden aus Phthalsäure, einer Dicarbonsäure, und aus Glycerin, einem dreiwertigem Alkohol, hergestellt.
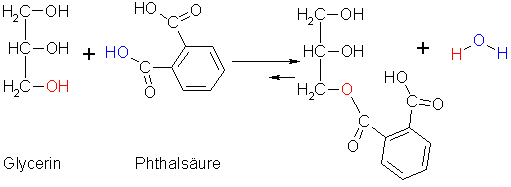
(6a)
Es bleiben funktionelle Gruppen übrig, an die weitere Monomere gebunden werden. So kommt es zur Bildung eines Polymers.
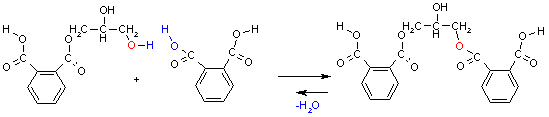
(6b)
Außer Wasser können bei Kondensationsreaktionen auch andere Moleküle wie Chlorwasserstoff frei gesetzt werden. Eine derartige
Reaktion läuft bei der Synthese von Nylon® ab. Nylon wird aus Hexandisäuredichlorid (Adipinsäuredichlorid) und Hexandiamin
hergestellt.
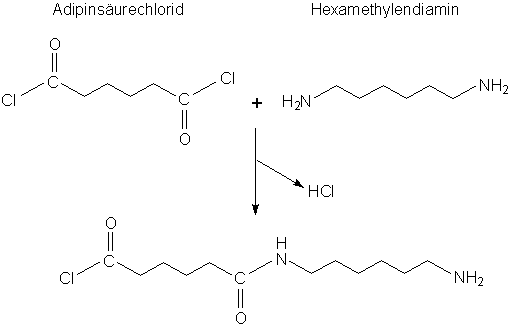
(6c)
In diesem Fall spricht man von Polyamiden.
Auch die Bildung von Phenol-Formaldehydharzen wie Bakelit beruht auf Kondensationspolymerisation, auch wenn man das auf dem ersten Blick nicht erkennt. Den Verlauf der Reaktion besprechen wir hier.
Weitere Reaktionen zur Bildung von Kunststoffen
Klicke hier.
Weitere Texte zum Thema „Kunststoffe“