Alkoholanaloge Schwefelverbindungen
Es gibt Verbindungen des Schwefels, die denen der Alkohole sehr ähneln. Für diese Verbindungsklasse gibt es verschiedene Begriffe: Man nennt sie Thiole, Sulfhydryle oder auch Mercaptane.
Was die Thiole strukturell von den Alkoholen unterscheidet, ist, dass sie statt des Sauerstoffatoms ein Schwefelatom besitzen. Ihre allgemeine Formel lautet somit statt R-OH
R-SH
Die Thiolgruppe (-SH) wird auch als Sulfhydryl- oder Mercaptogruppe bezeichnet. Wenn wir Alkohol
strukturell und in seinen Eigenschaften mit Wasser vergleichen, so müssen wir bei den Thiolen an
Schwefelwasserstoff denken. Daran erinnert uns auch die Bezeichnung Mercaptan. Die stammt von
dem lateinischen mercurium captans = Quecksilber fangend/fällend. Denn viele Thiole bilden
(wie H2S) mit Schwermetall-Ionen (Pb, Zn, Hg) schwerlösliche Verbindungen, in diesem Fall
ein Quecksilbersalz, das als Niederschlag ausfällt.
Charakteristisch für die Thiole ist weiterhin ihr äußerst unangenehmer Geruch, was auf die Anwesenheit
von Schwefel schließen lässt. Was organische Schwefelverbindungen mit Stinktier, Kater, Röstkaffee und
Liliengewächsen zu tun haben, kannst du übrigens hier nachlesen.
Thiole haben niedrige Siedepunkte
Im Gegensatz zu den Alkoholen haben die Mercaptane viel tiefere Siedepunkte. Z. B. siedet Methylmercaptan
(CH3SH) bei
Dazu kommt, dass sie viel weniger wasserlöslich als Alkohole sind, da sie kaum stabile Wasserstoffbrückenbindungen
zum Sauerstoff ausbilden können.
Thiole bilden Disulfidbrücken
Bei Proteinen spielt ein Wechselspiel zwischen Bildung und Lösen von Disulfidbrücken
eine wichtige Rolle. Sie tragen zur Kettenkonformation der α-Helix-Struktur und der β-Faltblattstruktur
bei und können u. a. durch Wechselwirkungen zwischen den Seitenketten der Aminosäuren kompakte Proteinmoleküle bilden.
Die dadurch hervorgerufene Tertiärstruktur gibt den Proteinen die endgültige dreidimensionale Form.
Um Disulfidbrücken aus Thiolen zu bilden, bedarf es nur etwas Luftsauerstoff:
2 R-S-H + ½ O2 ———> R-S-S-R + H2O
Diese Reaktion kann durch Reduktion wieder rückgängig gemacht werden. Übrigens, die Spaltung und Neubildung der -S-S-Verknüpfung ist auch für die Hautbildung auf der Milch mitverantwortlich.
Darstellung von Mercaptanen
Um Mercaptane zu synthetisieren, werden Alkylhalogenide mit Kalium- oder Natriumhydrogensulfid umgesetzt. Bei
dem Reaktionstyp handelt es sich um eine Nucleophile Substitution.
R-Cl + NaSH ———> R-SH + NaCl
Dabei ist zu beachten, dass zunächst beide Ausgangsstoffe hergestellt werden müssen. Außerdem erhält man nur eine gute Ausbeute, wenn die Alkylgruppe (-R) primär ist.
Verwendung
Mercaptane dienen als chemische Zwischenprodukte und werden in geringen Mengen zu Gasen zugesetzt,
die duftlos sind. Aufgrund des grässlichen Geruchs dieser Verbindungen, können sonst nicht riechbare, giftige
Gase selbst in sehr kleiner zugesetzter Konzentration des Thiols wahrgenommen werden.
Die Abkömmlinge der Thiole
Thioester
Analog zu den Derivaten der Alkohole gibt es auch Derivate der Thiole. Einer davon ist der Thioester. Hierbei
handelt es sich um esterähnliche Verbindungen, bei denen das Sauerstoffatom der Esterbindung durch ein Schwefelatom
ersetzt ist. Dies sieht dann folgendermaßen aus:
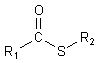
Ein wichtiger Thioester ist z. B. das Acetyl-CoA.
Thioether
Ein weiterer Abkömmling ist der Thioether. Das sind etherähnliche Verbindungen, in dem ebenfalls das
Sauerstoffatom durch ein Schwefelatom ersetzt ist. Die allgemeine Formel lautet R1-S-R2. Die Aminosäure
Methionin ist ein Thioether.