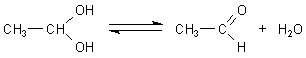
Polyole - Alkohole können mehr als eine OH-Gruppe besitzen
Experimente:
Versuch: Polyole bilden Komplexverbindungen
Alkohole, die mehr als eine Hydroxylgruppe haben, werden als mehrwertige
Alkohole, Polyalkohole oder Polyole bezeichnet. Allgemein bekannte Beispiele sind
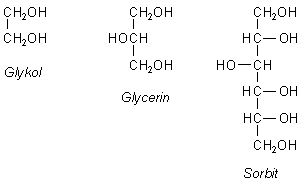
Glykol, Glycerin
und Sorbit. Genau genommen muss man die letzten
beiden Glycerol und Sorbitol nennen - wie es international auch der Fall ist. Der Begriff
Wertigkeit bezieht sich hier auf die Anzahl der OH-Gruppen. Wie verteilen
die sich aber über das Molekül?
Die Erlenmeyer-Regel
Es kann sich nie mehr als eine OH-Gruppe an einem Kohlenstoffatom befinden, da diese Verbindung
instabil wäre. Das besagt die Erlenmeyerregel. Solch eine Verbindung wäre auch gar kein Alkohol
mehr, sondern sein Oxidationsprodukt. Es eliminiert sofort ein Wassermolekül. Zurück bleibt ein
Aldehyd oder Keton.
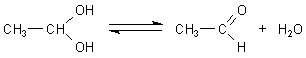
(Wir müssen etwas einschränken: Allerdings gibt es diese Moleküle - zum Beispiel beim Acetaldehyd in wässriger Lösung oder in anderen Ausnahmefällen wie beim stabilen Chloralhydrat.)
Bei Polyolen befinden sich die OH-Gruppen also an verschiedenen C-Atomen. Hier sind die Strukturen der oben erwähnten Polyalkohole.
Viele OH-Gruppen beeinflussen die Eigenschaften der Moleküle
Die mehrwertigen Alkohole sind dem Ethanol in vielerlei Hinsicht sehr unähnlich, denn sie haben
keinerlei berauschende Wirkung mehr und sind außerdem ungiftig (vom
Glykol einmal abgesehen). Unter ihnen findet man viele Stoffe, die als
Nahrungsbestandteile eine wichtige Rolle spielen.
Je mehr OH-Gruppen vorhanden sind, desto stärker treten die hydrophilen Eigenschaften des Alkohols in den Vordergrund. Deshalb sind mehrwertige Alkohole hervorragend in Wasser löslich, auch wenn sie aus längeren Kohlenstoffketten bestehen.
Der hydrophile Charakter ist so ausgeprägt, dass die Substanzen deutlich hygroskopisch sind.
Die Möglichkeit zur Bildung von H-Brücken wirken sich auch in der Art aus, dass die Substanzen mit zunehmender "Wertigkeit" immer zähflüssiger werden. Das heißt, dass ihre Viskosität zunimmt.
Außerdem steigt der Siedepunkt um ein Vielfaches an. Durch die zunehmende Möglichkeit, Wasserstoffbrückenbindungen auszubilden, wird mehr Energie benötigt, um die Verbindung zum Sieden zu bringen.
| Verbindung | Siedepunkt |
| Ethan | - 88,5 °C |
| Ethanol | + 78,4 °C |
| Ethandiol (Glykol) | + 197,4 °C |
Zudem nimmt der süße Geschmack zu, je mehr Hydroxylgruppen ein Alkohol enthält. Die Bezeichnungen Glykol und Glycerin enthalten das griechische Wort für "süß": glykos. Bei fünf- und sechsfachen Alkoholen ist der süße Geschmack schon so stark ausgeprägt, dass er nicht mehr von Zucker zu unterscheiden ist. Sorbit ist z. B. ein wichtiger sechswertiger Zuckeralkohol. Er stammt übrigens von der deutlich weniger süß schmeckenden Glucose ab und dient Diabetikern als Süßstoff.
Polyole bilden Komplexverbindungen
Wenn man zu alkalischen Lösungen von Polyolen Kupfer(II)-Salzlösungen zugibt, gibt es eine
deutliche Farbvertiefung in Richtung auf Blau (-> Versuch).

Polyol-Chelate von Kupfer(II): Von links nach rechts: Verdünnte CuSO4-Lösung,
Cu(II)-hydroxid, dann alkalische CuSO4-Lösungen mit Glykol, Glycerin, Triethylenglykol
und Sorbit
(Foto: Daggi)
Das liegt daran, dass die Kupfer(II)-Ionen mit den Polyolen Komplexe bilden. Es handelt sich
hierbei um den Komplextyp der Chelate. Direkte Bindungspartner
sind die Hydroxylgruppen, die in der Lauge und unter dem Einfluss der stark elektronenziehenden
Kupfer(II)-Ionen wahrscheinlich weitgehend als Anionen vorliegen.
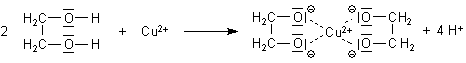
Struktur eines Glykol-Kupfer-Chelats
Das Vorliegen solcher Dihydroxy-Chelate vermutet man auch bei der Fehlingschen Lösung. Hier ist der Chelatbildner die Weinsäure.
Weitere Texte zum Thema „Alkohol“