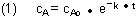
Wie verändert sich die Reaktionsgeschwindigkeit während der
Reaktion?
Experimente:
Versuch: Qualitative Demonstration der Entfärbung von Kristallviolett durch
Natronlauge
Versuch: Reaktionskinetik der Entfärbung von Kristallviolett
Die Erfahrung lehrt: Chemische Reaktionen verlaufen am Anfang rasch und werden
dann immer langsamer. Kann man dies auch mathematisch belegen?
Wir wählen das einfache Beispiel einer Reaktion 1. Ordnung
A ———> B
mit dem bekannten Konzentrations-Zeit-Gesetz
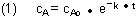
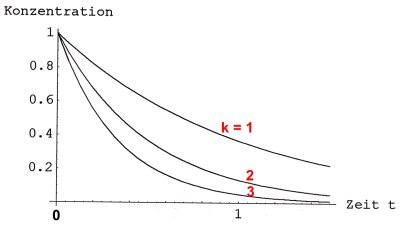
Bild 1: Reaktionen 1. Ordnung mit drei verschiedenen Werten der Geschwindigkeitskonstanten und gleicher Anfangskonzentration
Es gilt für den Absolutwert der Reaktionsgeschwindigkeit v
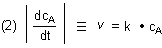
1. Änderung der Reaktionsgeschwindigkeit mit der Edukt-Konzentration
Statt der Konzentration führen wir die Umsatzzahl x ein. Das ist der Anteil von A, der
zum Zeitpunkt t bereits umgesetzt ist. Das hat Vorteile, wenn wir die mathematische
Herleitung vornehmen wollen. Vor allem erhalten wir dann auch aussagekräftige
Kurvenbilder, die mit unserer Erfahrung übereinstimmen.
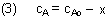
Eingesetzt in (2) folgt für das Geschwindigkeits-Konzentrations-Gesetz
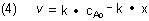
Wir tragen in einem Diagramm v gegen x auf: Es handelt sich um eine Gerade mit
der Steigung - k und dem Ordinatenabschnitt k · cAo.
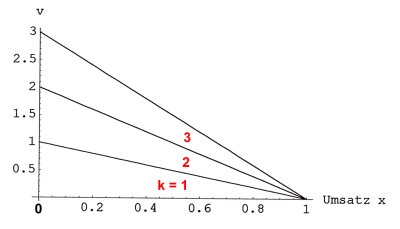
Bild 2: Abhängigkeit der Reaktionsgeschwindigkeit v vom Reaktionsumsatz
x für die drei Reaktionen in Bild 1. Die Anfangskonzentration ist jeweils gleich.
Wir sehen, dass mit steigendem Umsatz x (d. h. mit abnehmender Konzentration von Stoff A) die Reaktionsgeschwindigkeit grundsätzlich abnimmt. Die Reaktion ist beendet, wenn x = CAo wird, d. h. wenn der Stoff A aufgebraucht ist.
Wie kann man das auf molekularer Ebene erklären? Wenn nur noch wenige Moleküle des Stoffs A da sind, zerfallen auch immer weniger. Oder im Fall der pseudo-1. Reaktion
A + B ———> C
fehlt A als Stoßpartner zum Auslösen der Reaktion mit dem im Überschuss vorhandenen Reaktionspartner B.
Die Reaktionsgeschwindigkeit ist direkt proportional zur Anfangskonzentration CAo und außerdem auch zur Geschwindigkeitskonstanten k. Das gilt auch für die maximale Reaktionsgeschwindigkeit, für die Anfangsgeschwindigkeit v0.
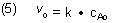
2. Änderung der Reaktionsgeschwindigkeit mit der Reaktionszeit
Hierzu betrachten wir noch einmal die Konzentrations-Zeit-Kurve. Die
Reaktionsgeschwindigkeit ist bekanntlich die erste Ableitung der Kurve nach der
Zeit, oder anders gesagt: Sie ist gleich der Steigung der Tangenten im
Konzentrations-Zeit-Diagramm.
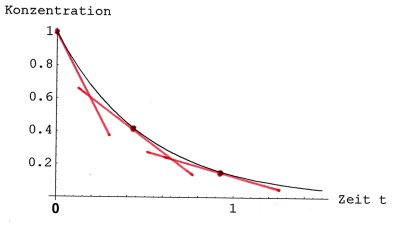
Bild 3: Eine Konzentrations-Zeit-Kurve für Reaktionen 1. Ordnung mit einigen
Tangenten
Wir sehen in Bild 3, dass die Steigung der Tangente im Startpunkt der Reaktion
(also bei t = 0) maximal ist; sie nimmt kontinuierlich ab, erreicht aber nie die
Steigung Null, da sich die Reaktion asymptotisch ihrem Ende nähert.
Zur Berechnung der Funktion v = f(t) setzen wir (1) in die Gleichung (2) ein:
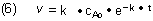
Folglich muss die Reaktionsgeschwindigkeits-Zeit-Kurve ebenfalls einen exponentiellen Verlauf haben.
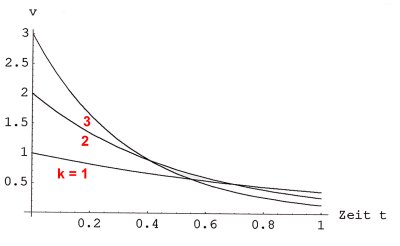
Bild 4: Reaktionsgeschwindigkeit als Funktion der Reaktionszeit für die drei
Reaktionen in Bild 1
Mit zunehmender Reaktionsdauer nimmt die Reaktionsgeschwindigkeit exponentiell ab.
Der maximale, also der Anfangswert v0 der Reaktionsgeschwindigkeit ist natürlich auch hier durch Gleichung (5) definiert. Er hängt gleichermaßen von der Geschwindigkeitskonstanten der Reaktion und von der Anfangskonzentration der Reaktionspartner ab.
Weitere Texte zum Thema „Reaktionskinetik“