Schwefelwasserstoff und chemische Analytik
Experimente:
Versuch: Bunte Reihe der Sulfide im Labor
Früher ging man vor allem nasschemisch an die Analyse eines Stoffgemischs heran. Das mag aus
heutiger Sicht zwar überflüssig sein. Heute werden Elementaranalysen mit den verschiedensten
Hilfsmitteln gemacht. Da gibt es die Atomabsorption (AAS), die verschiedenen Chromatographiearten
und sonstige apparative Methoden. Aber der Vorteil der "veralteten" Methoden lag auf der Hand:
Die Studenten lernten viel über grundlegende chemische Reaktionen, und darüber hinaus übten sie
sich noch in der praktischen Labortätigkeit.
So kannte jeder Chemiestudent den Begriff Schwefelwasserstoffgruppe. Darunter verstand man die Gruppe von Elementen, die beim Einleiten von H2S in ihre sauren Lösungen bestimmte, im Allgemeinen sehr auffällig gefärbte Sulfide bilden. Hier einige Beispiele:
| As2S3 | (gelb) |
| Sb2S3 | (rotorange) |
| Bi2S3 | (dunkelbraun) |
| HgS | (schwarz) |
| PbS | (braunschwarz) |
| CdS | (gelb) |
| CuS | (schwarz) |
| SnS | (braun) |
| Ag2S | (schwarzbraun) |
Kenner konnten schon aus der Reihenfolge des Auftretens der Farben auf die qualitative und quantitative Zusammensetzung der Analysensubstanz schließen. Man spricht treffend von Fällungskaskaden.
Dazu gibt es noch andere Sulfide, die erst in schwach saurem (Acetatpuffer), neutralem oder schwach alkalischem Milieu ausfallen. Dies ist die so genannte Ammoniumsulfid-Urotropin-Gruppe.

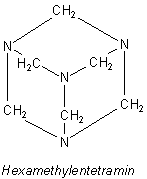
Urotropin ist Hexamethylentetramin. Es setzt in Lösung und vor allem beim Erwärmen Ammoniak frei und sorgt so für ein schwach alkalisch gepuffertes Milieu.
N4(CH2)6 + 6 H2O ———> 4 NH3 + 6 HCHO
Beispiele für diese Gruppe sind:
| Co2S3 | (schwarz) |
| NiS | (schwarz) |
| MnS | (fleischfarben) |
| ZnS | (farblos) |
Dazu gehören auch noch Metalle wie Fe, Al und Cr, die auch im alkalischen Milieu gar keine Sulfide bilden, sondern nur Hydroxide.
Unter welchen Bedingungen die Sulfide (oder natürlich auch die Hydroxide) ausfallen, ist eine Frage des Löslichkeitsprodukts.

Im stark sauren Milieu gibt es zwar viel H2S, dazu etwas HS- und besonders wenige S2- -Ionen. Aus diesem Grunde fallen dort nur die schwerlöslichen Sulfide aus.
Sagenhaft ist das Löslichkeitsprodukt vom Quecksilber(II)-sulfid HgS mit 10-54. Das hat dazu geführt, dass man diese Verbindung für total ungiftig gehalten hat. Hart gesottene Assistenten (echte "Assis" also) machten das früher vor: Sie pflegten im Labor von der roten HgS-Modifikation (Zinnober) vor den staunenden Studenten eine Portion zu sich zu nehmen und mit einem kräftigen Schluck Bier herunterzuspülen. Seit man aber weiß, dass Bakterien selbst aus dem "unlöslichen" HgS nerventoxisches Methylquecksilber machen, ist man vorsichtiger geworden.
Es soll nicht vergessen werden, darauf hinzuweisen, dass die Sulfide auch Grundlage von Pigmentfarben (Körperfarben) für Malerzwecke waren und wohl hier oder da auch noch sind.
Weitere Texte zum Thema „Schwefel“