Prof. Blumes Tipp des Monats Februar 2006 (Tipp-Nr. 104)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Erhellendes um das Blitzlicht
Das Fotografieren war früher viel urtümlicher als heute. Jeder, der etwas auf sich hielt, hatte sein eigenes Entwicklungslabor. Im köstlichen Old-Timer-Film Noblesse oblige mit Sir Alec Guiness war dies das Gartenhaus, das zur Abkürzung einer adeligen Erbfolge abgefackelt wurde... Im bürgerlichen Milieu war das Fotolabor meistens nur ein Raum im Keller, dessen Fenster mit einer Wolldecke abgedunkelt wurden. Dort lag allerlei Chemisches herum, was man zum Fotografieren benötigte, und das blieb dann bis zur Entsorgung liegen. So auch diese alte Packung mit Blitzlichtpulver.
| Klick mich an! |
 |
| Bild 1 (Foto: Daggi) |
Wenn man genau hinsieht, erkennt man auf der dunklen Banderole einen Text:
| 10 gebrauchsfertige ADOX BLITZ Beutel
Kühl, trocken u. feuersicher aufzubewahren |
Das klingt nach Gefahrenbelehrung. Die ist nicht grundlos, wie wir gleich sehen werden! Heute verwenden wir für die chemische Blitzlicht-Mischung das Gefahrensymbol F: Leichtentzündlicher Stoff.

Wir Chemiker sind neugierige Leute. Deshalb haben wir das Briefchen geöffnet. Leider war nur noch eine letzte Packung darin, eine rote Tüte mit einem dunklen Pulver. An der Tüte waren ein langer Papierstreifen und ein Draht befestigt. Letzterer war zu einer Schlaufe geformt.

Bild 2 (Foto: Daggi)
Damit machten wir natürlich eine Funktionsprobe. Die musste unbedingt gelingen - weil ja nur noch eine
Probe zur Verfügung stand. Die Drahtschlaufe nutzen wir zur Aufhängung des Briefchens am Stativ. Wir
falteten dann den Papierstreifen auseinander, ordneten ihm die Funktion einer Zündschnur zu und steckten
ihn an. Es funktionierte alles prächtig - wenn auch nicht so ganz rauchfrei, wie versprochen.
 |
| Bild 3 (Foto: Daggi)
Hierzu gibt es einen Film (400 KB) Klicke hier |
So einen Effekt nennt man (wie mein Sohn Thomas meint) in der Film-Branche eine space-explosion...
Auf diese Weise hat man tatsächlich früher Lichtblitze produziert, um auch im Dunkeln fotografieren zu können.
Vor dem Zündeln haben wir uns den Tütcheninhalt noch genauer angesehen. Wir haben zunächst Magnesiumpulver identifiziert. Was aber war das Oxidationsmittel? Eine Probe auf Peroxide (wie Bariumperoxid BaO2) mit Titanylsulfatreagenz war negativ. Weitere Proben ergaben: Das Oxidationsmittel ist Kaliumchlorat KClO3.
3 Mg + KClO3 ———> 3 MgO + KCl + Energie
|
Versuch 1: Das chemische Blitzlicht I
Wir benötigen feines Magnesiumpulver (F) mit der Korngröße < 0,3 mm. Wir mischen davon 1,8 g mit 3 g trockenem
Kaliumchlorat (Xn,O). Dabei auf keinen Fall mörsern! Die Menge reicht für zwei Versuche.
|

Bild 4 (Foto: Daggi)
Es gab übrigens auch Blitzlichter, die als Oxidationsmittel Kaliumpermanganat enthielten.
3 Mg + 2 KMnO4 ———> 3 MgO + K2O + 2 MnO2 + Energie
Probieren wir auch das noch einmal aus.
|
Versuch 2: Das chemische Blitzlicht II
|
Die Effekte sind phänomenal. Würden wir ohne gute Sonnenbrille in die Flamme schauen, so sähen wir für
einige Zeit gar nichts mehr. Was müssen die Leute, die mit solchen Blitzlichtern fotografiert wurden, gelitten
haben! So wie dieser tapfere Soldat, der dabei von seinem Einsatz für Kaiser und Reich träumen durfte...

Bild 5 (Foto: Sammlung Blume)
Das waren keine Blitzlichter, das waren Blendgranaten!
Deshalb (vor allem wohl auch wegen der Brandunfälle, der vom Rauch ausgelösten Atemnöte und vor allem wegen der Erblindungen) besann man sich anderer Möglichkeiten. Man bemühte sich zumindest um geschlossene Reaktionssysteme.
Der Vacublitz
Die Alternative war eine Glühbirne, der so genannte Vacublitz. Die Bezeichnung ist irreführend, denn
es handelte sich mitnichten um eine evakuierte Lampe. Anders als die üblichen Glühlampen war sie mit Sauerstoff
gefüllt. Wenn ein unedles Metall in reinem Sauerstoff verbrennt, entsteht ein grelles Licht.
4 Al + 3 O2 ———> 2 Al2O3 + Energie
Das lässt sich mit dem besonders unedlen Aluminium schon in der Luft zeigen. Dazu muss das Aluminium feinstverteilt als so genannte "Aluminiumbronze" vorliegen.
|
Versuch 3: Der Aluminiumlichtblitz
Wirklich frisches, feinstes Aluminiumpulver (F) wird auf eine Unterlage wie die Platte eines Dreifußes gehäufelt.
Nicht zu viel nehmen! Dann wird davor ein Bunsenbrenner mit entleuchteter Flamme gestellt. Mit einem langen Glasrohr
oder mit einem Trinkhalm blasen wir das Pulver in die Flamme. Der das machen muss, sollte dabei zusätzlich zum
Aufsetzen der Sonnenbrille die Augen schließen.
|
Nehmen Sie den Sicherheitshinweis ernst! Ich habe einmal als nebenamtlicher Lehrer den Versuch zum Alu-Blitz Schülern vorgeführt und dabei ohne Blendschutz gearbeitet. Es dauerte einen halben Tag, bis ich wieder halbwegs sehen konnte! Die Schüler haben nur deshalb nichts gemerkt, weil ich links und rechts vom absolut blinden Fleck im Zentrum noch insgesamt 10 % Sehfläche behalten hatte. Zum Sehen musste ich immer meinen Kopf drehen - wahrscheinlich sah das aus wie bei einem Huhn.
Der erste Vacublitz wurde 1925 gebaut. Es war ein glühlampenähnlicher, mit Magnesiumsplittern gefüllter Glaskolben einer ordinären Glühbirne, der elektrisch gezündet wurde. Später wurde in den Glaskolben Aluminiumfolie hineingepackt. Zuletzt diente ein sehr langer, dicht geknäuelter feiner Draht aus Aluminium als Blitzquelle. Opas ungebrauchte Vacublitzlichtbirnen werden für Sammler angeboten.
Der feine Alu-Glühfaden wurde wie in einer normalen Glühbirne elektrisch aufgeheizt und so gezündet.
Allerdings war nach einmaliger Nutzung der Vacublitz nur noch für den Abfall gut. Denn dann war die aus dünnem
Glas und aus schützendem Kunststoff gefertigte Umhüllung des Lämpchens regelrecht geschmolzen. Daran änderte sich
letztlich auch nichts, als Kodak die Blitzwürfel einführte. Die waren eben nach viermaligem Gebrauch nutzlos
geworden. Es war also an der Zeit, sich um Blitzlichter zu bemühen, die immer wieder genutzt werden konnten.
Der moderne Elektronenblitz
Hier halfen Gasentladungslampen. Das Prinzip kennt man vielleicht schon von der Glimmlampe aus der Schule.
Mit der werden anhand eines aufleuchtenden Gases, das sich zwischen zwei Elektroden befindet, elektrische
Aufladungen wie zum Beispiel der piezoelektrische Effekt nachgewiesen.

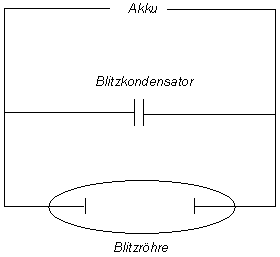
Bild 6: Glimmlampe (Foto: Daggi) und einfaches Schema einer Gasentladungslampe
Dahinter steckt ein ausschließlich physikalischer Effekt. Wenn man Gasatome (wie zum Beispiel von den Edelgasen
Argon oder Xenon) einem elektrischen Feld aussetzt, so werden ihre Elektronen angeregt. Die Atome können sogar
ionisiert werden. Was sich da bildet, nennt man den vierten Aggregatzustand oder auch nur Plasma.
Die so aufgemischten Elektronen kehren innerhalb von 10-8 bis 10-9 Sekunden wieder in ihren
ursprünglichen Zustand zurück; ihre Energie wird dabei als Licht abgegeben. Das kennen wir auch von den so genannten
Neonröhren. Bei kontinuierlicher Energiezufuhr gibt es auch kontinuierliches Licht.
Je höher die angelegte Spannung ist, desto heller ist das Licht. So arbeitet man bei Elektronenblitzgeräten mit 10 Kilovolt (abgekürzt kV). Die Spannung baut sich in einem Kondensator auf. Dessen Entladung bewirkt einen kurzen Energiepuls, der den einmaligen Lichtblitz zur Folge hat.
Natürlich ist alles viel komplizierter, als die Skizze oben ahnen lässt. Hier ist ein Schaltbild eines realen Elektronenblitzgeräts, das von Ernst Leitner und Uli Finckh (Studiendirektoren am Rupprecht Gymnasium München) erstellt wurde.
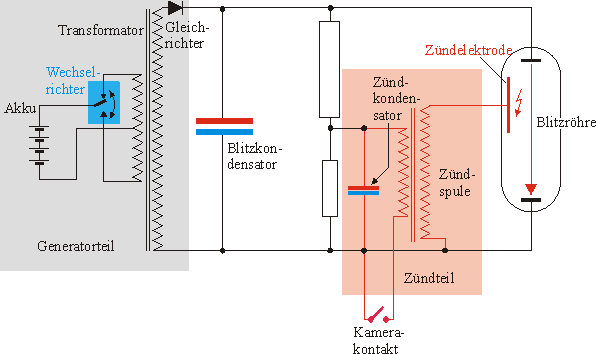
Bild 7: Schaltbild eines Elektronenblitzgeräts
(Quelle: Mit freundlicher Erlaubnis durch http://www.physik.uni-muenchen.de/leifiphysik/web_ph12/musteraufgaben/01elektrfeld/blitzger/blitzlicht.htm)
Wir sehen: Genau genommen enthält das Gerät zwei Kondensatoren, den eigentlichen Blitzkondensator und einen
Zündkondensator. Der Grund: Der Blitzkondensator kann sich über die Blitzröhre noch nicht entladen, da die
Gasstrecke in der Röhre zunächst noch isolierend wirkt.
Mit dem Zündkondensator wird über eine Zündspule durch die Entladung einer hohen Spannung in der Blitzröhre
zunächst ein elektrischer Blitz erzeugt. Dadurch wird das Edelgas ionisiert. Die Gasstrecke zwischen den Elektroden
der Blitzröhre ist nun leitend geworden. Damit kann sich anschließend der Blitzkondensator entladen. Diesen Vorgang
begleitet der bekannte Lichtblitz.
Mit einem Elektronenblitzgerät kann man Zehntausende von Blitzen erzeugen, ohne es ständig erneuern zu müssen. Zur Erinnerung: Wenn man die Aufladungen pulst, hat man ein Stroboskop. Das ist der bekannte Lichtblitzwerfer aus der Disko oder aus der Autowerkstatt, mit dem Drehzahlen von Motoren und der Zündwinkel kontrolliert werden.
Dieses Blitzlicht gibt es natürlich nicht kostenlos zu haben. Seine Auslösung erfordert viel elektrische Energie. Die bezieht man aus Batterien oder Akkus, also aus galvanischen Elementen. Das sind bekanntlich Reaktionssysteme, die chemische Energie in elektrische umwandeln.
Wir Chemiker stellen deshalb wieder einmal bescheiden, wenn auch mit etwas Stolz fest: Letztlich ist auch der physikalische begründete Elektronenblitz des alltäglich genutzten Fotoapparats ohne Mitwirkung der Chemie nicht möglich.
Aktivierung mit Blitzlicht
Im Schullabor nutzt man das Blitzlicht zum Aktivieren der exothermen Chlorknallgas-Reaktion.
H2 + Cl2 ———> 2 HCl + Energie
Das funktioniert aber nur mit den chemischen Blitzen. Die Elektronenblitzlampen strahlen zu wenig Energie ab, so dass die Radikalkettenreaktion nicht einsetzt und der Knall ausbleibt.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 14. August 2008, Dagmar Wiechoczek