Prof. Blumes Tipp des Monats Juli 2010 (Tipp-Nr. 157)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wie groß sind eigentlich Moleküle?
Das können Schüler mit Hilfe des „Öltropfenversuchs“ experimentell sogar selbst bestimmen.
|
Versuch 1: Vorbereitung der Lösungen für den Öltropfenversuch
|
Nun rechnen wir aus, wie viel Ölsäure in einem Milliliter der zweiten Lösung ist.
Die erste Lösung enthielt 1/50 ml Ölsäure. Wird die wieder auf 1:50 verdünnt, so enthält ein Milliliter der zweiten Lösung 1/50 · 1/50 = 1/2500 ml Ölsäure.
|
Versuch 2: Öltropfenversuch
|
Das Ergebnis entspricht durchaus dem, welches wir in der Literatur [1] finden. Jetzt müssen wir noch wissen, wie viele Tropfen in einem Milliliter sind. Beim Titrieren geht man davon aus, dass ein Tropfen 0,03 ml entspricht, dass also ein Milliliter etwa 30 Tropfen bildet. Dann enthält ein Tropfen der zweiten Lösung 1/2500 · 1/30 = 1/75000 ml Ölsäure.
Nun berechnen wir die Länge L eines Ölsäuremoleküls. Wir gehen dazu davon aus, dass der Film, den die Ölsäure auf dem Wasser bildet, wie bei den Tensiden monomolekular ist („Köpfchen in das Wasser, Schwänzchen in die Höh´“…).
Das Volumen des Öltröpfchens ist dann wie das Volumen eines Zylinders mit der Höhe L zu berechnen.

Die Dicke des Ölfilms beträgt also 2,1 · 10-7 cm, also 2,1 ·
10-9 m oder 21 · 10-8 cm. Mit physikalisch gebräuchlichen Maßeinheiten
drückt man Letzteres so aus: 2,1 nm (Nanometer) bzw. 21 Ångström.
Kann das in etwa stimmen?
Wir erinnern uns, dass der Durchmesser eines H-Atoms 1 Ångström beträgt. Nun ist ein Carbonsäuremolekül viel länger.
Das „starre“ Molekül von Stearinsäure ist schon 2,45 nm oder 24,5 Ångström lang. Das eher gewinkelte Molekül der Ölsäure
sollte etwas kleiner sein - wie wir ausgerechnet haben.
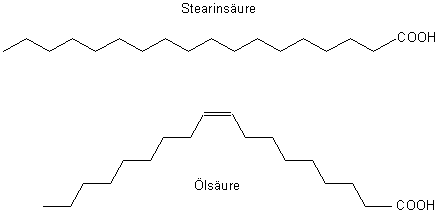
Stearinsäure und Ölsäure im Vergleich
Zum Schluss ein wichtiger Hinweis
Man sollte bei dem Versuch nicht höchst genaue Werte erwarten. Dafür sind die Fehlermöglichkeiten zu groß.
Aber im Allgemeinen erhält man Ergebnisse, die zumindest hinsichtlich der Größenordnung stimmen.
Übrigens wird in der Literatur empfohlen, den Versuch auf dem Arbeitsprojektor durchzuführen. Aber auch hier sind Fehlerquellen vorprogrammiert, wozu unter anderem das Rütteln des Kühlgebläses sowie die Aufheizung des Gefäßes mit entsprechender Konvektionsströmung des Wassers gehören.
Rüdiger Blume
Literatur:
Nach: [1] H. Menke und R. Sichelschmidt, NiU, 23, 1975
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 28. Juli 2010, Dagmar Wiechoczek