Prof. Blumes Tipp des Monats Juli 1998 (Tipp-Nr. 13)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wöhlers Harnstoff und die Enzymdiagnostik
Die Wöhlersche Harnstoffsynthese 1828 und die Formulierung des Schlüssel-Schloss-Prinzips durch Emil Fischer 1904 waren Marksteine der Chemiegeschichte. Warum solltet ihr nicht mal beide in einer kleinen Unterrichtseinheit miteinander verbinden? Und dabei bedient ihr euch eines modernen Verfahrens, der Enzymdiagnostik. Wöhlers klassischer Versuch ist also keineswegs ein alter Hut.
Wöhler stellte Harnstoff aus dem isomeren Ammoniumcyanat her:
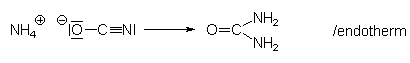
Mit diesem Versuch riss er bekanntlich die Mauern zwischen der organischen Chemie (damals ausschließlich Biochemie) und der anorganischen Chemie ein. Zu dieser Entdeckung gibt es einen erfrischend-deftigen Schriftwechsel zwischen Wöhler und seinem Mentor Berzelius, den zu lesen sich unbedingt lohnt.
Die Identifizierung des so hergestellten Harnstoffs in der Reaktionsmischung macht im Schullabor Schwierigkeiten: Normalerweise müsstest du den Harnstoff aus der Reaktionsmischung mit absolutem (d.h. wasserfreiem) Ethanol isolieren. Dann bestimmst du den Schmelzpunkt (132 °C) oder machst dazu noch die Biuretprobe (s. u.). Das ist alles sehr aufwendig und im Schullabor sowie in der kurzen Zeit einer Schulstunde kaum machbar. Vor allem ist die Konzentration an Harnstoff oftmals einfach zu gering, z. B. wenn du die Ausgangsmischung zu stark erhitzt hast. Glücklicherweise gibt es aber die Urease, ein hochspezifisches Enzym, das nur mit Harnstoff und sonst keinem anderen Molekül reagiert.
OC(NH2)2 + H2O ———> CO2 + 2 NH3 /exotherm
Das kannst du durch Vergleich mit ähnlichen gebauten Molekülen wie dem
Thioharnstoff zeigen (s. u.). Harnstoff und Urease passen also zusammen wie
Schlüssel und Schloss. Wenn das Enzym mit der nach Wöhler hergestellten
Reaktionsmischung reagiert, ist dies ein hundertprozentiger Beweis dafür, dass darin
Harnstoff vorliegt. Bei diesem Verfahren lernst du somit auch das Grundprinzip von
Enzymtests kennen.
(Wenn du etwas Genaueres über die Urease wissen willst, klicke hier:
Urease für Experten.)
Am besten gehst du die folgenden Texte und Versuche der Reihe nach durch.
Die Wöhlersche Harnstoffsynthese
Friedrich Wöhler ging bei seiner Synthese von Ammoniumcyanat NH4OCN aus.
Dies kann man nicht kaufen, wohl aber Kaliumcyanat KOCN. Mische deshalb
Ammoniumchlorid mit Kaliumcyanat, um die Reaktionsmischung zu erhalten.
|
Versuch 1: Harnstoffsynthese nach Wöhler
Schülerversuch, 5 min. Geräte
Chemikalien
Durchführung (Schutzbrille)
|
Die zwei Möglichkeiten zum Harnstoffnachweis
1 Die Biuretreaktion
Zunächst wird der klassische Nachweis auf Harnstoff, die Biuretprobe, durchgeführt.
Biuret bildet sich aus zwei Harnstoffmolekülen unter Ammoniakabspaltung:
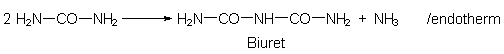
Biuret stellt man normalerweise durch Erwärmen von Harnstoff her. Unter den
Bedingungen der Wöhlerschen Harnstoffsynthese hat sich davon genügend
gebildet.
Bei der Nachweisreaktion handelt es sich um eine Komplexbildung mit Kupfer-Ionen.
(Da Biuret eine gewisse Ähnlichkeit mit der Peptidbindung in Proteinen aufweist, gilt
die Biuretprobe auch als Nachweis für lösliche Proteine.)
Bei dem folgenden Versuch wird auf den Zusatz von stabilisierenden Komplexbildnern
wie Seignettesalz verzichtet. Es reicht aus, mit Kupfersulfatlösungen zu arbeiten.
|
Versuch 2: Vereinfachte Biuretprobe
Schülerversuch, 5 min. Geräte
Chemikalien
Durchführung
|
2 Enzymtest mit Urease
Die Urease ist ein Enzym, die Harnstoff hydrolysiert. Dabei entsteht neben
Kohlenstoffdioxid Ammoniak, das in Lösung Hydroxid-Ionen bildet. Die zunehmende
Alkalinität der Lösung dient als Hinweis für die "Tätigkeit" der Urease.
Dass der Harnstoff das ausschließliche Substrat der Urease ist, zeigt der
Vergleich mit dem N,N-Dimethylharnstoff. Mit diesem reagiert die Urease nicht. (Bis vor kurzem
nahm man hierzu Thioharnstoff. Das Experimentieren hiermit ist neuerdings für Schüler
verboten.)
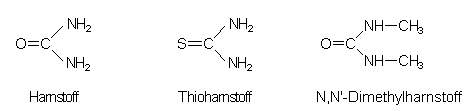
Man sagt, dass die Urease eine große Enzymspezifität aufweist. Damit kann die Urease zum Enzymtest herangezogen werden. Mit ihr gelingt auch der Nachweis geringster Konzentrationen an Harnstoff.
|
Versuch 3: Demonstration der Substratspezifität der Urease Schülerversuch, 5 min. Geräte
Chemikalien
Durchführung
Ergebnis
|
Mit dem Wissen um die Substratspezifität der Urease machen wir nun den Enzymtest auf Harnstoff.
|
Versuch 4: Enzymatischer Nachweis von Harnstoff in der Wöhlerschen
Produktmischung
Schülerversuch, 5 min. Geräte
Chemikalien
Durchführung
Ergebnis
|
Das Bildungsgleichgewicht des Harnstoffs aus Ammoniumcyanat
In seinem Brief an Berzelius vermutet Wöhler, dass es gar
keinen Unterschied zwischen cyansaurem Ammonium (NH4OCN) und Harnstoff gibt. In
gewisser Weise lag er damit ganz richtig:
Grundlage der Wöhlerschen Synthese ist nämlich die Tatsache, dass sich in
Lösungen, in denen Ammonium- und Cyanat-Ionen vorliegen, ein Gleichgewicht ausbildet:
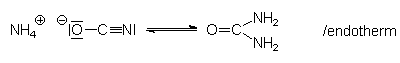
Dieses Gleichgewicht verschob Wöhler bei seiner Synthese in Richtung auf die
Harnstoffbildung, indem er die Gleichgewichtsmischung erwärmte. (Hier wendete
Wöhler vorausgreifend das Prinzip von Henry Louis Le Chatelier
an, das dieser in der allgemein bekannten Form allerdings erst 1884 formulierte.) Da die
Rückbildung gehemmt ist, bleibt Harnstoff nach dem Erwärmen erhalten.
Mit Hilfe des Enzymtests kannst du nachweisen, dass schon bei Zimmertemperatur
Harnstoff in merklichen Konzentrationen in Ammoniumcyanatlösungen vorhanden ist
bzw. sich ständig nachbildet.
|
Versuch 5: Nutzung des Enzymtests zur Gleichgewichtsanalyse Schülerversuch, 10 min. Geräte
Chemikalien
Durchführung (Schutzbrille)
Ergebnis
|
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. November 2011, Dagmar Wiechoczek