Prof. Blumes Tipp des Monats August 2012 (Tipp-Nr. 182)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Zum Cola-Rost-Mythos
Es wird endlich warm, und es wird viel getrunken, zum Beispiel Cola-Getränke. Unweigerlich kommt die Frage auf, ob es stimmt, dass man damit Rost entfernen könne. Entsprechend häufig sind die Anfragen. Man kann natürlich spotten: Warum probieren das die Leute nicht einfach mal aus?
| Probieren statt Spekulieren… |
Unser Nachbar renoviert gerade sein Haus, deshalb liegen da genug rostige Nägel herum. Wir haben einige eingesammelt und damit den folgenden Versuch gemacht, den jeder leicht nachmachen kann:
|
Versuch 1: Cola als Rostentferner?
|

Bild 1: Rostige Nägel nach vier Stunden in Wasser (links) und Coca Cola® (rechts)
(Foto: Blume)
Fazit: Mit Coca Cola® kann man keinen Rost entfernen.
Wenn wir schon dabei sind:
Gibt es andere Getränke, die zum Rostentfernen geeignet sind?
Auch hierzu machen wir einen Versuch. Wir wählen möglichst viele Getränke.
|
Versuch 2: Getränke als Rostentferner
Ergebnis (Bild 2): Citronensäure-haltige Getränke haben den Rost zersetzt („aufgelöst“). Gleiches gilt zunächst auch für das Kohlensäure-haltige Mineralwasser. Das zeigt allerdings bald eine Trübung, die sich bräunlich färbt. Hinweis: Frisch entrostete Nägel sind nicht metallisch blank! Eisen enthält nämlich Kohlenstoff, der an den ehemaligen Roststellen deutlich zutage tritt, und graue, nicht glänzende Eisen-Kohlenstoffverbindungen. |

Bild 2: Rostige Nägel nach vier Stunden in verschiedenen Flüssigkeiten (siehe Versuch 2)
(Foto: Blume)
Citronensäure und Kohlensäure sind also in der Lage, Rost zu zersetzen. Das wird dadurch erleichtert, dass sich mit der
Citronensäure leicht lösliche, gelbe Komplexe bilden. (Klicke hier.)
Cola schmeckt zwar süß, ist aber die Lösung einer Säure. Coca Cola® enthält jedoch anders als die meisten Limonaden keine Citronensäure, wohl aber Kohlensäure. Diese spielt offenbar keine sonderliche entrostende Rolle, wie man aus dem Vergleich von über Nacht abgestandener Cola mit frisch geöffneter folgern kann.
Das viel kritisierte Säuerungsmittel ist vielmehr Phosphorsäure. Die ist zwar in der Lage, Rost zu zersetzen. Dabei bildet sich aber schwerlösliches Eisenphosphat, das das noch nicht zersetzte Oxid mit einem undurchlässigen Überzug versieht, so dass sich die Zersetzung selbst ausbremst.
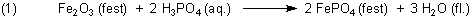
Diese Reaktion macht man sich bei den Rostumwandlern zunutze.
Rost hat bekanntermaßen eine blättrige Struktur und haftet schlecht auf dem Eisen. Dazu kommt, dass die Rostschicht
durchlässig ist für die Korrosionsfaktoren Wasser, Sauerstoff und Elektrolyte.
Was man zum Schutz vor fortschreitendem Rosten benötigt, ist eine fest haftende und dazu auch undurchlässige Schicht, auf der man auch Farben aufbringen kann. Dazu nutzt man die Phosphorsäure bzw. saure Phosphatlösungen.
Zunächst muss man den Rost mechanisch entfernen (zum Beispiel mit einer Drahtbürste). Die Reste des Rosts bzw. die Eisen(III)-Ionen werden von der Phosphorsäure in gut haftendes Eisenphosphat überführt.
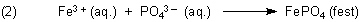
|
Versuch 3: Grundreaktion der Rostumwandler
|
Was ist mit Kohlensäure-haltigem Mineralwasser?
Bei Versuch 2 hatten wir gesehen, dass kohlensäurehaltige Lösungen den Rost erst zersetzen, dass sich aber bald eine
milchige, rostfarbige Trübung bildete.
Zunächst hat die Kohlensäure den Rost zersetzt. Dabei spielt aber nur die erste Dissoziationsstufe der Kohlensäure eine Rolle.
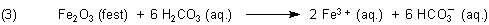
Die Hydrogencarbonat-Ionen sind instabil. Sie zerfallen unter Abgabe von CO2. Zurück bleiben Hydroxid-Ionen.
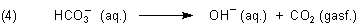
Die Hydroxid-Ionen reagieren mit den Eisen(III)-Ionen zu braunem Eisen(III)-hydroxid, der Grundsubstanz von Rost.
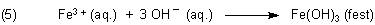
Nach anfänglicher Rostentfernung setzt somit die Rostneubildung bald wieder ein.
Aber Cola sprudelt doch auch. Warum entrostet sie dann nicht?
Diese Frage wird öfter gestellt. Das sprudelnde Gas ist CO2 - also muss Cola doch Kohlensäure enthalten!
Und wirkt ja - wie wir gerade gesehen haben - entrostend.
Betrachten wir die bekannte Gleichgewichtsreihe des CO2/H2O-Systems:
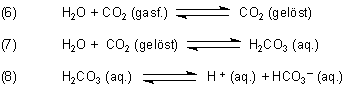
Cola-Getränke sind wegen der Anwesenheit von Phosphorsäure sauer. In solchen Lösungen wird das Dissoziationsgleichgewicht (8) nach links verschoben.
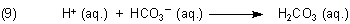
Die so entstehende Kohlensäure ist nicht stabil, da sie gemäß
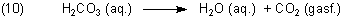
zerfällt. Man kann auch sagen, dass unter Einwirkung der Phosphorsäure die Gleichgewichtsreihe (6-8) des CO2/H2O-Systems rückwärts verläuft.
Das ist der Grund, weshalb die phosphorsaure Cola so stark sprudelt. Und weshalb sich der Rost in Cola nicht zersetzt, obwohl sie augenscheinlich CO2 enthält. Es ist schlicht überhaupt keine aktive Kohlensäure bzw. Hydrogencarbonat-Ion zum Entrosten vorhanden.
Die gleiche Argumentation gilt analog für Citronensäuresprudel.
Warum setzt man dann überhaupt Getränken CO2 zu?
CO2 ist physiologisch wirksam, es ist quasi eine Droge. Es fördert die Durchblutung der Haut und regt den Kreislauf an. Insgesamt
kommt es zu dem prickelnden Gefühl, das man bei Genuss CO2-haltiger Getränke so schätzt. Übrigens fördert es auch den Übergang von Alkohol ins Blut
- gut zu wissen für Trinker von Bier oder Champagner.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 15. August 2013, Dagmar Wiechoczek