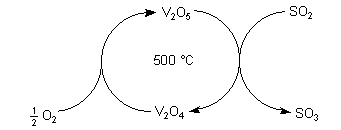|
Prof. Blumes Tipp des Monats Oktober 2001 (Tipp-Nr. 52)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Herstellung von Schwefeltrioxid
Bild 1: Kristalle von asbestartigem Schwefeltrioxid
(Foto: Daggi) |
Anders als das gasförmige Schwefeldioxid ist Schwefeltrioxid ein Festkörper, der bei
Zimmertemperatur in hübschen asbestartigen Nadeln kristallisiert (-> Bild). Zur
Gewinnung ist die direkte Oxidation von Schwefeldioxid durch Sauerstoff nicht
möglich. Denn dies ist eine Gleichgewichtsreaktion, bei der die Reaktionsenergie
kleiner ist als die notwendige Aktivierungsenergie. Deshalb zerfällt SO3 in der Hitze
eher, als dass es sich bildet.
Diese Substanz kann man aber dennoch leicht durch Oxidation von SO2 herstellen.
Dazu gibt es zwei Wege. Als Oxidationsmittel dient Sauerstoff. Reaktionsvermittler ist
einmal Stickstoffdioxid, das andere Mal Vanadium(V)-oxid. Beide Stoffe sind aber
auch direkt als Oxidationsmittel für SO2 geeignet. Diese Reaktionen spielen bei der
katalytischen Herstellung nach dem Bleikammerverfahren sowie nach dem
Kontaktverfahren eine Rolle. Da wir hier nicht kontinuierlich arbeiten, ist der Aspekt der
Katalyse jedoch nicht besonders gut zu erkennen.
Wir geben hier zwei Vorschriften, bei denen sich Schwefeltrioxid augenblicklich als
weißer Festkörper bildet.
Bei der Oxidation von SO2 unter Mitwirkung der Stickoxide färbt sich das
Gasgemisch von Braun (NO2) nach Farblos (NO).
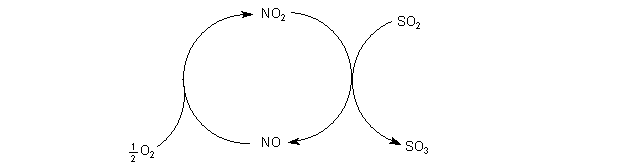
Oxidation von Schwefeldioxid durch Stickoxid-Katalyse
|
Versuch 1: Oxidation von Schwefeldioxid durch Stickoxide
Demonstrationsversuch; 15 min.
Hinweis
Der katalytische Aspekt kann wegen apparativen Schwierigkeiten bei der
kontinuierlichen Zufuhr der Gase nicht gezeigt werden. Deshalb wird nur demonstriert,
dass Stickoxide prinzipiell Schwefeldioxid zu oxidieren vermögen.
Die Reaktion wird als trockene Gasreaktion gezeigt. Schwefeltrioxid bildet sich als
fester, weißer Stoff (nadelförmige Kristalle). Da er eine hohe Dichte hat, befindet er
sich nur in der unteren Hälfte des Kolbens.
Da NO2 braun gefärbt ist und NO farblos ist, kann man den Fortgang der Reaktion
auch über die Gasentfärbung verfolgen.
Geräte
Gasentwicklungsapparatur mit Tropftrichter, schwerschmelzbares Reagenzglas,
einfaches Reagenzglas, Bunsenbrenner, 2 Kolbenprober, Zweihalskolben (250 ml) mit
Quickfit oder Stopfen.
Chemikalien
Natriumbisulfit Na2S2O5 oder Natriumsulfit
(wasserfrei) (T), Schwefelsäure (konz.), Blei(II)-nitrat (T), destilliertes Wasser,
Bariumchloridlösung (gesättigt) (Xi), Salzsäure (konz.) (C).
Durchführung
1 Herstellung der Gase (Abzug!)
Schwefeldioxid (T)
Man übergießt in einer Gasentwicklungsapparatur Natriumbisulfit mit Schwefelsäure
und füllt mit dem Gas einen Kolbenprober.
Stickstoffdioxid (T)
Blei(II)-nitrat (T) wird zu einem Drittel in ein schwerschmelzbares RG gefüllt und über
der Brennerflamme erhitzt. Man füllt mit dem braunen Gas (NO2) einen Kolbenprober.
Es enthält herstellungsbedingt die gleiche Menge an Sauerstoff.
2 Oxidationsreaktion
In einen Dreihalskolben füllt man eine halbe Kolbenproberportion NO2 und zwei
Kolbenproberportionen SO2 ein. Der Kolben wird verschlossen. Es bildet sich rasch an
der unteren Glaswand ein weißer Niederschlag von SO3. Man kann die weißen
Schlieren nach unten absinken sehen.
Nach kurzer Zeit hellt sich das Gas auf. Die völlige Gasentfärbung kann ca. eine
Stunde dauern.
Wenn man dann das Gefäß öffnet, färbt sich das Gas wegen der Reaktion des
farblosen Stickstoffmonooxids NO mit Sauerstoff zu Stickstoffdioxid NO2 wieder braun.
Hinweis
Wenn man vor der Reaktion Gegenstände wie Steinchen, Glasstücke oder ähnliches
in den Kolben gibt, kann man (wenn man Glück hat) die nadelförmigen Kristalle frei
wachsen sehen. Uns ist das mit einem Teflonrührfisch gelungen (-> Bild).
|
Bild 2: Schwefeltrioxidkristalle am Rührfisch
(Foto: Blume) |
Bei der Oxidation von SO2 unter Mitwirkung der Vanadium-Oxide ändert das
Vanadium seine Oxidationszahl. Vanadium(V)-oxid ist gelborange, Vanadium(IV)-oxid
ist blauschwarz.
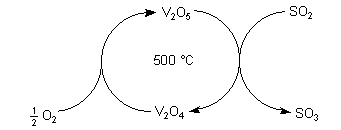
Oxidation von Schwefeldioxid durch Vanadium-Oxid-Katalyse
|
Versuch 2: Oxidation von Schwefeldioxid in Gegenwart von Vanadium-Oxid
Schülerversuch; 10 min.
Geräte
Quarzrohr (Durchmesser 1 cm), Schlauchmaterial, Quarzwolle, Kolbenprober, zwei
Bunsenbrenner oder einen mit breitem Aufsatz, Rundkolben (1 l),
Tropfpipetten, Reagenzgläser.
Chemikalien
Natrium(bi)sulfit (wasserfrei) (Xn), Schwefelsäure (konz.) (C), Salzsäure (konz.) (C),
Bariumchlorid (Xn), Sauerstoff (O), Vanadium(V)-oxid V2O5.
Durchführung
Vorbereitungen
Man füllt je einen Kolbenprober zu einem Drittel mit Sauerstoff aus einer
Gasdruckflasche und zu zwei Drittel mit Schwefeldioxid aus einer
Gasentwicklungsapparatur. Letztere enthält Natrium(bi)sulfit, das man mit
Schwefelsäure übergießt.
Getrocknetes Vanadium-Oxid wird locker in ein Quarzrohr gefüllt. Nicht stopfen. Das
Quarzrohr verschließt man mit Quarz- oder Glaswolle.
Auf der einen Seite schließt man den Kolbenprober mit der Gasmischung an.
Auf der anderen Seite schließt man einen Rundkolben ohne Wasser an.
Oxidationsreaktion
Nun erhitzt man das Quarzrohr mit dem Vanadium-Oxid. Dabei verfärbt es sich
dunkel. Dann schiebt man langsam in kleinen Portionen die Gasmischung in den
Reaktionsraum. Es bilden sich weiße Nebel von Schwefeltrioxid, die in den
Rundkolben übergehen und zu Boden sinken.
Das Vanadium-Oxid kann schmelzen; das stört die Reaktion aber nicht.
|

Bild 3 (Foto: Daggi)
Die Reaktionsprodukte kann man auf folgende Weise untersuchen:
|
Versuch 3: Nachweis der Reaktionsprodukte
Man saugt oder bläst die Auffanggefäße aus, bis sie nicht mehr nach SO2 riechen.
Dann löst man den weißen Niederschlag mit möglichst wenig destilliertem Wasser auf.
Man prüft mit Indikatorpapier oder mit einem pH-Meter.
Dann gibt man etwas Salzsäure und Bariumchloridlösung zu.
Ergebnis
Die Lösung ist stark sauer. Es bildet sich ein farbloser Niederschlag von Bariumsulfat.
Beim gebildeten weißen Stoff handelt es sich also um Schwefeltrioxid, das Anhydrid der
Schwefelsäure.
|
Diese Versuche sind zugleich ein kleiner Ausblick auf unsere neue Webseite
"Katalysatoren und Enzyme".
Es gibt noch eine andere Möglichkeit, Schwefeltrioxid aus Schwefeldioxid herzustellen. Der
Katalysator ist diesmal Aktivkohle. Darauf beruht ein Verfahren zur Rauchgasentschwefelung. Darüber
berichten wir in einer besonderen Webseite - auch diesmal
wieder mit Hinweisen zum Experimentieren.
Rüdiger Blume
Weitere Tipps des Monats
Diese Seite ist Teil eines großen Webseitenangebots
mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 14. April 2010, Dagmar Wiechoczek
|