Prof. Blumes Tipp des Monats November 2004 (Tipp-Nr. 89)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Distickstoffmonoxid
Stickstoffchemie ist reizvoll. Vor allem die Beschäftigung mit hochreaktiven Nitraten und mit den reaktiven Stickoxiden ist hier zu nennen.
Da gibt es aber auch ein Stickstoffoxid, von dem man landläufig annimmt, dass es chemisch kaum reagiert, welches also chemisch gesagt "ein toter Hund" ist. Es handelt sich um Distickstoffmonoxid N2O.
Es gibt viele Gründe, sich im Unterricht mit Distickstoffmonoxid
zu befassen
Beispielsweise findet man es als süßlich riechendes Treibgas in Sahnesiphons. Wir
greifen vor: Distickstoffmonoxid ist nicht brennbar, aber es ist wie Sauerstoff
ein brandförderndes Gas. Deshalb sollte man es mit der Glimmspanprobe nachweisen können.
|
Versuch: Nachweis von N2O aus Sahnesiphons
|

Bild 1 (Foto: Daggi)
Distickstoffmonoxid heißt auch Lachgas, weil es als Bestandteil von Narkosegasen die
Gesichtsnerven beeinflusst, wodurch ein grinsender Gesichtsausdruck entsteht.
Seine narkotisierende Wirkung ist übrigens Grund dafür, dass Kids dieses Gas, das sie aus den Sahnesiphons abzapfen, zum Sniffen verwenden. Übrigens können sie leider auch Gaskartuschen mit N2O kaufen, die für bestimmte Sahnebehälter bestimmt sind.
Und schließlich nutzt man Distickstoffmonoxid sogar noch zum Tunen von Benzinmotoren!
Wie wird Distickstoffmonoxid hergestellt?
Beim vorsichtigen Erhitzen von Ammoniumnitrat zerfällt das Salz nach
folgender Gleichung:
2 NH4NO3 + Energie ———> 4 H2O + 2 N2O
Der Versuch zur derartigen Herstellung von N2O gelingt allerdings in der Schule kaum, da man im Allgemeinen nicht über trockenes Ammoniumnitrat (O) verfügt. Es dampft beim Hochheizen in einem Ölbad auf etwa 200 °C soviel Wasser ab, dass der Wasserdampf die Glimmspanprobe unmöglich macht. Man könnte vielleicht auch eine Mischung von Ammoniumsulfat und Natriumnitrat (O) nehmen. Das funktioniert unter schulischen Bedingungen aber auch nicht richtig. Allerdings ist vor dem Versuch, zur Gewinnung von N2O das Ammoniumnitrat in einem Reagenzglas über dem Brenner direkt zu erhitzen, dringend abzuraten. Denn dabei kann man die Temperatur nicht kontrollieren. Schließlich beginnt die Zersetzung ab 300 °C außer Kontrolle zu geraten. Dann zerfällt Ammoniumnitrat explosionsartig:
Ammoniumnitrat + Hitze (> 300 °C) ———> Wasserdampf, Stickoxide (NO, NO2), Stickstoff
Wir haben das selbst getestet. Eine Spatelspitze von dem Salz ergab beim Erhitzen schon ein beachtlich lautes "Blopp"... Und es wurde dabei auch eine Menge braunes Stickstoffdioxid NO2 freigesetzt und in Form hübscher Rauchringe abgedampft. Distickstoffmonoxid haben wir dabei nicht erhalten.
(Auf ein entsprechendes Experiment ist auch das historische Unglück in Oppau (1921) zurückzuführen. Um das hygroskopische und deshalb festgebackene Ammoniumnitrat-Ammoniumsulfatgemisch, das man auf einer riesigen Halde gelagert hatte, zu lockern, pflegte man es mit Dynamit auseinanderzusprengen. Das ging lange gut - bis dann eines Tages alles zusammen (4500 Tonnen!) in die Luft flog. Bilanz: Ein Riesenloch und 500 Tote.)
Distickstoffmonoxid ist also ein brandfördernder Stoff und trägt deshalb das
Gefahrensymbol O. Wie Sauerstoff brennt das Gas selbst nicht, aber es hält
Verbrennungen aufrecht.
Mit schulischen Mitteln ist die Abgrenzung zu Sauerstoff schwierig. Denn neben Holz oder Kohle brennen
auch andere Substanzen in Distickstoffmonoxid. So reagieren Schwefel oder Phosphor mit diesem brandfördernden
Gas. Mit Wasserstoff gibt es (wenn auch etwas schwächer als mit Sauerstoff) Knallgasexplosionen. Berüchtigt
heftig ist die Umsetzung mit Ammoniak.
Distickstoffmonoxid ist zum Tunen von Motoren wichtig
Schüler wollen oft wissen, warum das Einspritzen von Lachgas in Motoren deren Leistung steigert. Tatsächlich
spielt das eine Rolle beim Motorsport.
Dazu muss man wissen, dass wie auch CO2 Distickstoffmonoxid leicht verflüssigbar ist. Sein Siedepunkt beträgt -88,5 °C. Deshalb kann es in Gasflaschen abgefüllt werden.
Für seine Wirkung als Motorleistungs-Tuner sind mehrere Effekte verantwortlich:
| 1 | Flüssiges N2O lässt sich unterhalb seiner Siedetemperatur von
-88,4 °C leicht verflüssigen. Es wird in eine Gasdruckflasche ("Bombe") abgefüllt, unter hohem Druck aufbewahrt
und im Auto oder Flugzeug mitgeführt. Obwohl das Gas in der Gasflasche die Temperatur der äußeren Umgebung annimmt,
bleibt es flüssig ("Überkritisches Gas"). Das Gas kühlt aber stark ab, wenn man es ausströmen lässt. Grund: Die
Wechselwirkung zwischen den "zusammenklebenden" Gasmolekülen muss überwunden werden, und das kostet Energie.
(Darauf beruht ja auch das Linde-Verfahren zur Luftverflüssigung.)
Abkühlung könnte man aber auch mit Wassereinspritzung erreichen. |
| 2 | N2O hat aber noch einen zusätzlichen Effekt: Bei höheren Temperaturen
(> 600 °C) zersetzt sich N2O und bildet die Elemente Stickstoff und Sauerstoff im Verhältnis 2:1.
N2O ———> N2 + ½ O2 Es ist somit ein Transportsystem für hochreaktive Sauerstoffatome. Man spricht deshalb vom Ozon der Stickstoffchemie. Dieses Gasgemisch ist also reicher an Sauerstoff (2:1) als Luft (4:1). Das wirkt sich fast so aus, als wenn man statt Luft direkt Sauerstoff zuführen würde. Die Leistung des Motors wird dadurch erheblich gesteigert. |
| 3 | Durch das Verdampfen des Flüssiggases (1) und durch seinen Zerfall (2) wird das
Gasvolumen im Zylinder stark erhöht, das bedeutet Drucksteigerung.
Vorsicht aber: Zufuhr von reinem Lachgas anstelle von Luft kann den Motor durch Überhitzung zerstören. |
Erfunden wurde das Ganze übrigens im 2. Weltkrieg für hochfliegende Flugzeuge. Denen ging in einer Flughöhe oberhalb von 10 km aufgrund der dünnen Luft der Sauerstoff für die Treibstoffverbrennung aus.
Das Verfahren wurde später vor allem im Motor-Rennsport eingesetzt. Ob es heute noch zugelassen ist,
weiß ich nicht. Es gibt aber die Möglichkeit, Privat-Kfz nachzurüsten.
Suchen Sie im Internet unter dem Stichwort "NOS". Die Abkürzung steht für Lachgastuning.
Für Spezialisten: N2O ist treibhausaktiv
Das Molekül ist stäbchenförmig aufgebaut. N2O ist isoelektronisch mit CO2.
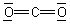
Die Moleküle liegen aber anders als die von CO2 von vornherein als permanente Dipolmoleküle vor.
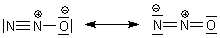
Man muss wissen: Der Treibhauseffekt hat viel mit der Wechselwirkung zwischen den Atmosphärengasen und
der elektromagnetischen Strahlung zu tun (Infrarot gehört dazu!). Denn wenn ein Gasmolekül ein permanenter
Dipol ist, kann die elektromagnetische Strahlung dieses wie eine Antenne benutzen. (Beim CO2 wird
dieser Dipol durch Molekülschwingungen erst aktiviert.)
Distickstoffmonoxid ist deshalb um Größenordnungen stärker Infrarot-aktiv als CO2
und ist folglich ein effektives Treibhausgas. Da es durch viele andere technische
Prozesse wie bei der Verkokung, aber auch bei natürlichen Vorgängen wie bei der
bakteriellen Denitrifikation oder Nitrifikation entsteht, ist es in der
Atmosphäre als Spurengas weit verbreitet und hat einen nicht unbedeutenden
Anteil am Treibhauseffekt.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 28. August 2014, Dagmar Wiechoczek