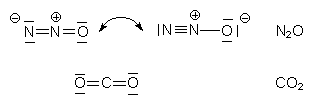
Etwas zur Chemie der Stickoxide
Experimente:
Versuche zum Distickstoffoxid N2O
Versuch: Luftverbrennung
Versuch: Luftverbrennung in einer Kerzenflamme
Versuch: Herstellung von Stickoxiden durch Reaktion zwischen Kupfer und HNO3
Versuch: Oxidation von NO zu NO2
Versuch: Herstellung von NO2 durch Erhitzen von Bleinitrat
Versuch: Das NO2/N2O4-Gleichgewicht
Versuch: NOx als Säureanhydrid
Versuch: Nachweis von NOx, Nitrit und Nitrat mit der Ringprobe
Versuch: Nachweis von Nitrit und NOx mit der Saltzman-Probe
Versuch: NOx-Nachweispapier
Versuch: Nachweis von Nitrat mit Saltzman-Reagenz
Versuch: Quantitativer Nachweis von Nitrat als Natriumnitrosalicylat
Versuch: Zerstörung von Farbstoffen durch NOx
Versuch: Oxidationswirkung von Kaliumnitrat
Versuch: Eliminierung von Amino-Stickstoff
Versuch: Vergiftung von Kresse durch Schadgase
Versuch: Versuche zum Autoabgaskatalysator
Versuch: Versuch zur Entstickung von Kraftwerksabgasen
Die wichtigsten Stickoxide sind:
| N2O | Distickstoff-oxid |
| NO | Stickstoff-mono-oxid |
| NO2 | Stickstoff-dioxid |
| N2O4 | Distickstoff-tretra-oxid |
Distickstoffoxid
Distickstoffoxid N2O, das in der Medizin unter der Bezeichnung "Lachgas" immer
noch als Betäubungsmittel genutzt wird, ist völlig inert.
Es ist isoelektronisch mit Kohlenstoffdioxid:
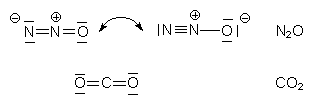
Daher ist es "nur" ein (wenn auch sehr effektives) Treibhausgas.
Es wird nicht nur bei Verbrennungsvorgängen (vor allem bei Waldbränden und beim
Betrieb von Kokereien), sondern auch bei bodenbakterieller Tätigkeit im
Nitratstoffwechsel erzeugt. Dass mit diesem geruch- und geschmacklosen Gas auch die
Schlagsahne zur sonntäglichen Torte aufgeschäumt wird, soll nur am Rande erwähnt
werden. N2O ist allerdings langfristig Quelle für Schadgase wie die
NOx. Man nennt es deshalb ein Quellgas.
(Andere Quellgase sind z. B. Schwefeldioxid, FCKW, CKW, Methan, Lösemittel...)
Das Betäubungsmittel Lachgas wird gern in Discos inhaliert!
Zum Distickstoffoxid haben wir einen Tipp des Monats.
Reaktive Stickoxide NOx
Alle anderen Stickoxide sind akut toxisch und wirken schädigend auf die Atmosphäre.
Man fasst sie unter der Bezeichnung NOx
zusammen. Sie sind alle chemisch eng miteinander verwandt. Sie bilden sich in der Natur durch
Blitzschlag. Dessen Energie ist so hoch, dass Stickstoff und Sauerstoff direkt miteinander
reagieren.
Das farblose NO stellt man im Labor am einfachsten her, indem man farblose Salpetersäure mit einem sauberen Kupferblech reagieren lässt ("auflöst") (-> Versuch).
3 Cu + 2 HNO3 + 6 H+ ———> 3 Cu2+ + 2 NO + 4 H2O
An der Luft wird NO sofort zum braunen NO2 oxidiert (-> Versuch).
2 NO + O2 ———> 2 NO2
NO2 gewinnt man auch durch Erhitzen von Bleinitrat (-> Versuch).
2 Pb(NO3)2 ———> 2 PbO + 4 NO2 + O2
In der Technik erhält man es auch durch katalytische Ammoniakverbrennung.
Dieses Gas riecht chlorartig. Du kannst es morgens im Berufsverkehr riechen. Dann
arbeiten nämlich die Katalysatoren, die die Autoabgase reinigen sollen, noch nicht
ausreichend.
NO2 steht im Gleichgewicht mit seinem farblosen Dimeren
N2O4 (-> Versuch).
Bei Zimmertemperatur bestehen 80 Vol% des vorliegenden NO2 eigentlich aus N2O4.
Die gleichen Stoffe entstehen auch durch Luftverbrennung (-> Versuch). Schon die Hitze einer Kerzenflamme (-> Versuch) reicht zur Bildung von Stickoxiden aus.
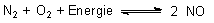
Dieses Gleichgewicht liegt sehr ungünstig, wie der folgenden Tabelle zu entnehmen ist:
| t °C | Vol% |
| 200
700 1200 1800 1900 |
10-7
0,04 0,1 0,5 1 |
Als endotherm gebildete Substanz sollte das NO bei Verlassen der heißen Räume sofort wieder zerfallen. Dass das nicht geschieht, liegt daran, dass der Zerfall von NO unterhalb von 450 °C stark gehemmt ist und eine hohe Aktivierungsenergie erfordert. NO ist also metastabil. Das ist die Ursache für das Umweltproblem, das uns der Betrieb von Kfz beschert. Andererseits erkennen wir den Lösungsweg für das Problem: Wir müssen die Aktivierungsenergie senken - durch Katalysatoren. Dies ist die Grundlage für die Verfahren zur Kfz-Abgasreinigung.
Dass der Prozess der Luftverbrennung endotherm ist, hat auch zur Folge, dass NO nicht unermesslich entstehen kann. Die Faustregel "Je höher die Temperatur, desto mehr NOx bildet sich" stimmt nur bis 1900 °C. Bei höherer Verbrennungstemperatur wird die Aktivierungsenergie zum exothermen Zerfall von NO überschritten. Folglich nimmt die NO-Bildung bei Temperaturen über 1900 ° wieder ab. Dies zeigt die folgende Graphik.
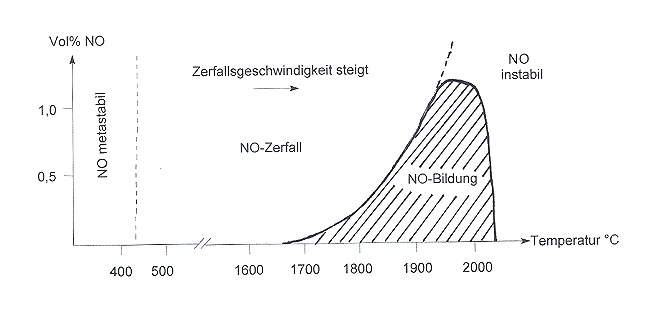 |
| Bildung und Zerfall von Stickstoffmonoxid NO (nach Holleman und Wiberg) |
Wenn das Gleichgewicht der Luftverbrennung so ungünstig liegt: Warum bilden sich dann überhaupt
nennenswerte Mengen an Stickoxiden?
NO reagiert im Motor bei ausreichendem Sauerstoffangebot sofort weiter:
2 NO + O2 ———> 2 NO2
Letzteres wiederum dimerisiert - vor allem in der Abkühlphase:
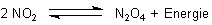
Die Folgereaktionen sorgen für ständigen Abfluss des NO. Damit verschiebt sich das Gleichgewicht auf die Seite der Bildung. Dies ist eine Anwendung des Prinzips von Le Chatelier.
Das System NOx/Nitrit/Nitrat
Es bestehen auch chemische Verwandtschaften zu den Nitrit- und Nitrat-Ionen. Denn
die Stickoxide reagieren mit Wasser unter Säurebildung, sind also Säureanhydride
(-> Versuch). Beispiele sind:
4 NO2 + 2 H2O + O2 ———> 4 HNO3 (Salpetersäure; Salze Nitrate)
2 NO2 + H2O ———> HNO2 + HNO3 (Salpetrige Säure; Salze Nitrite)
Das folgende Schema zeigt diese Zusammenhänge. Du erkennst hier Bereiche des Stickstoffkreislaufs wieder.
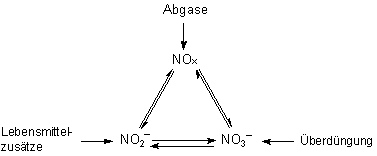
Deshalb kann man alle Spezies zusammen mit der klassischen Ringprobe nachweisen
(-> Versuch). Die schöne
Farbreaktion nach Saltzman (früher Lunge) für
Nitrit-Ionen funktioniert auch mit NOx (-> Versuch).
Deshalb kann man auch NOx-Nachweispapier zur Luftuntersuchung herstellen
(-> Versuch).
Nitrat-Ionen müssen allerdings zuvor reduziert werden (-> Versuch).
Das gelingt z. B. mit Zinkpulver.
Andererseits gibt es für Nitrat-Ionen spezielle, quantitative Nachweise, die auf der
Nitrierung von Aromaten beruhen (-> Versuch).
Stickoxide sind hochreaktiv und deshalb auch Gifte
| 1 | Die Toxizität von NOx beruht zunächst auf der schon beschriebenen Bildung starker Säuren. | ||||
| 2 | Dazu kommt die oxidierende
Wirkung von NO2, die z. B. bei der Entstehung von bodennahem Ozon
wirksam wird, aber auch Grundlage der Abgasreinigung
durch Katalysatortechnik ist; z. B. (-> Versuch):
4 CO + 2 NO2 ———> 4 CO2 + N2 Die oxidierende Wirkung von Stickstoff/Sauerstoffverbindungen wird deutlich, wenn man das Gas auf empfindliche Farbstoffe einwirken lässt (-> Versuch). Die Oxidationskraft kann man auch anhand der Nitrate zeigen (-> Versuch). |
||||
| 3 | Ursache für direkte Toxizität ist auch die
Reaktion mit Aminogruppen, die zu verschiedenen Produkten
führt. Die Reaktionen lassen sich am besten formulieren, wenn man vom Nitrit-Ion
ausgeht:
Auf der Reaktion mit Aminen beruht das DENOX-Verfahren zur Abgasreinigung bei Heizkraftwerken und Müllverbrennungsanlagen (-> Versuch). Es handelt sich hier um eine Symproportionierungsreaktion. 4 NH3 + 6 NO ———> 5 N2 + 6 H2O |
||||
| 4 | Mit Eisen-Ionen bilden sich Komplexverbindungen. Darauf beruht auch die Ringprobe. NO verdrängt deshalb auch Sauerstoff aus seinen Bindungen zum Hämoglobin und oxidiert zugleich dessen Fe2+-Ion . Es bildet sich inaktives Methämoglobin (MetHb). Der Hauptangriffspunkt ist aber die Endoxidation der Atmungskette in den Zellen, das Enzym Cytochromoxidase. | ||||
| 5 | Außerdem sind NO und NO2
Radikale, die im Gewebe andere Radikale bilden können. Hieraus
ist auch ihre Wirksamkeit als Atmosphärenschadstoffe zu verstehen. Stickoxide
spielen vor allem in der Ozonchemie bei der bodennahen
Ozonbildung sowie bei der stratosphärischen
Ozonausdünnung eine unheilvolle,
weil katalytische Rolle.
|
All diese Wirkungen machen die Stickoxide zu einer lebensfeindlichen Mischung. Das zeigt auch der Versuch, in ihrer Gegenwart Kresse wachsen zu lassen (-> Versuch).
Seit einigen Jahren weiß man, dass NO ein wichtiges Gewebshormon ist. Es wird im Körper oxidativ aus der Aminosäure Arginin gebildet und spielt durch seine Gefäß erweiternde Wirkung bei der Regulierung (genau: Senkung) des Blutdrucks eine wichtige Rolle. Es wird auch beim enzymatischen Abbau von Nitroglycerin, einem effektiven medikamentösen Blutdrucksenker, freigesetzt. Die Bildung von NO wird übrigens auch durch Potenzmittel wie Viagra gesteuert. Zur physiologische Wirkung von Nitroglycerin und NO haben wir eine Folie.
Man kann nun darüber spekulieren, ob auch das in der Umwelt befindliche NO in den Körper gelangt und hier pharmakologisch wirksam wird.
Weitere Texte zum Thema „Auto“