Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Dezember 2016 (Tipp-Nr. 234)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Uwe Lüttgens
„Leise rieselt der Schnee …“ Sicherlich verbindet so mancher von uns dieses Lied immer weniger mit der romantischen, winterlichen Pracht einer wie von Puderzucker überzogenen Naturlandschaft.
Und die Prognosen auf schneereiche Winter in unseren Breitengraden scheinen dank der prognostizierten, weiter voranschreitenden Erderwärmung nicht gerade günstig zu stehen. Also werden sich einige denken:
Da mache ich mir meine Winterwelt halt selbst, zu Hause. Will man einen Schneesturm im Wohnzimmer entfesseln, ist eine erste Maßnahme das Aufstellen einer Schneekugel -
als Souvenir ist sie ja beliebtes Mitbringsel aus dem Urlaub. Bild 1: Der Berliner Bär und ein Kamel aus Dubai – beide im Schneegestöber
Künstlicher Schnee, der möglichst echt aussehen soll – zumindest auf den ersten Blick – wird von Filmemachern benötigt, wenn beispielsweise eine winterliche Szene im Sommer am Set gedreht werden soll.
In den Szenen für den Film „Bridge of Spies“ von Steven Spielberg (2015) ist Kunstschnee in verschiedenen Formen z. B. an der Glienicker Brücke im Berlin zum Einsatz gekommen [1]. Auch Schaufester-Dekorateure, die ihre neue Winterkollektion bereits im Herbst anpreisen wollen, greifen ebenso gerne auf Kunstschnee zurück wie so mancher Hobby-Modellbauer. Mit dem Schnee aus der Tüte kann er mit
einigem Aufwand romantische Winterlandschaften auf die Modelleisenbahnplatte zaubern.
Bild 2: Tannenzweige, ohne und mit künstlicher weißer Pracht
Schauen wir uns den Kunstschnee doch mal genauer an. Was steckt chemisch hinter den Begriffen?
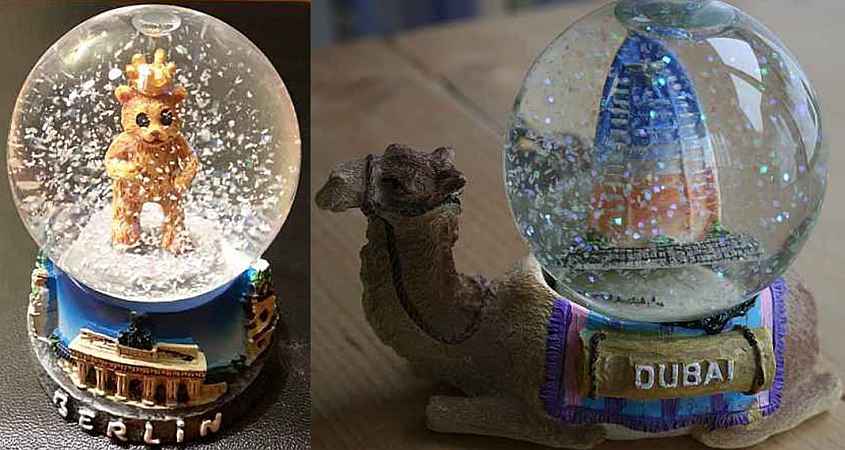
(Foto: Lüttgens)
Winter im Wohnzimmer?
Glitzernder Schnee zur Dekoration, magischer Zauberschnee, Bioschnee aus Maisstärke, Schnee aus Papier oder auch „Selfmade“-Schnee aus Rasierschaum und Backpulver – eine winterliche „Idylle“ lässt sich auf
vielfältige Weise zaubern. Denn: Angeboten werden die verschiedensten Kunstschnee-Sorten [2]. Alle erinnern durch ihre Farbe – natürlich weiß –, ihr Aussehen, ihre Textur (lat. textura: Gewebe) bzw. ihre Haptik
(griech. Lehre vom Tastsinn) an natürlichen Schnee. Die Bilder der präparierten Tannenzweige mögen einen ersten Eindruck liefern. Vielleicht kann ich ja meine Frau mit dem einen oder anderen Produkt überzeugen,
um unsere Familie beim Weihnachtsfest zu verzaubern.
(Foto: Lüttgens)
1. Glitzernder Dekorationsschnee
Die Werbetexter lassen sich einiges einfallen, um für den Dekorationsschnee zu werben. Gesprochen wird von der „perfekten Illusion...!“ oder auch: „Zaubern Sie sich Schnee zu jedem Anlass und bei jeder Temperatur“. Der „Profi-Kunstschnee“ soll mit hoher Deckkraft real wirken und eine „sensationelle Winterlandschaft zaubern“ können – egal, ob als lockerer Puderschnee oder zur Bildung einer geschlossenen Schneedecke, selbst als fallender Neuschnee soll er herhalten. Das Glitzern möchte sogar für einen „authentischen“ Frosteffekt sorgen. Ob dem so ist, mag jeder selbst entscheiden.

Bild 3: Tannenzweige, mit glitzerndem Dekorationsschnee bedeckt
(Foto: Lüttgens)
Deko- und Glitzerschnee bestehen aus kleinen Schnipseln, für die Kunststofffolien einfach nur gehäckselt werden müssen. Diese können sich mehr oder weniger rasch elektrostatisch aufladen, wie ein kleiner Versuch mit einem Kunststoffstab zeigt, der zuvor an einem Seidentuch gerieben wurde. Viel Spaß mit der Entsorgung …

Bild 4: Glitzerschnee lädt sich schnell elektrostatisch auf und „klebt“ nicht nur an geladenen Kunststoffstäben.
(Foto: Lüttgens)
Chemisch handelt es sich bei dieser Kunstschneevariation um den thermoplastischen Kunststoff Polyethylen (PE) [1].
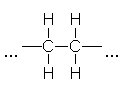
Polyethylenmolekül (Ausschnitt)
Wer mehr über Kunststoffe erfahren will, der findet hier weitere Informationen.
Für Spezialisten
Auffällig ist die geringe Dichte des Glitzerschnees: Typischerweise wiegt 1 Liter „Schnee-Flocken“ um die 30 g. Dies entspricht einer Dichte von D = 0,03 g/cm3. Allerdings handelt es sich um die sogenannte Schüttdichte,
da sich die Masse auf das Volumen des Granulats mit all seinen Poren bezieht und nicht auf das Volumen ohne die vielen kleinen Luftpolster.
Zum Vergleich: Sogenanntes Low-Density-Polyethylen (LDPE), das weich und flexibel sein muss, damit sich daraus z.B. Plastikfolien und -tüten herstellen lassen, hat eine Dichte D von vielleicht 0,92 bis 0,93 g/cm3. Dies wird durch einen größeren Anteil sperriger Seitenketten am Grundgerüst erreicht, die für einen lockeren Aufbau mit einer entsprechend geringeren Dichte sorgen im Vergleich zu High-Density-Polyethylen (HDPE) mit einer Dichte D von über 0,94 g/cm3. Der Thermoplast besteht dann nur zu etwa 35 - 45 % aus kristallinen Bereichen, in denen sich die Molekülfäden parallel ausrichten können.
2. Magischer Zauberschnee
„Easy to mix…Amazing to watch!“ Dann wollen wir mal den Zauberschnee ausprobieren. Dieser kursiert unter verschiedenen Produktnamen wie z. B. „Magic Snow“ oder „Insta-Snow“. Er besteht aus einem Granulat aus Natrium-Polyacrylat. Der Kunststoff quillt beeindruckend auf, wenn Wasser hinzugegeben wird. (Er ist bekannt als wasserverbindender Superabsorber-Kunststoff in Windeln, wie im Tipp des Monats nachzulesen ist.) So benötigt man viel, viel weniger Material, um eine riesige Menge „Schnee“ zu produzieren. Ein Anbieter spricht von bis zu 50 Litern Schnee, der mit einer 500 g-Tüte produziert werden kann.

Bild 5: Zauberschnee-Granulat
(Foto: Lüttgens)
In einer Gebrauchsanweisung heißt es, dass zu 50 g Zauberschnee 2 l Wasser gegeben werden, um „trockenen Puderschnee“ zu erzeugen. Will man „Schneematsch“ produzieren, werden einfach nochmal 2 l Wasser hinzugegeben. Damit bindet der Kunststoff schätzungsweise das 80fache des Eigengewichts an Wasser. Das grenzt an Zauberei. In einer zweiten Anleitung ist von 60 ml Wasser auf 5 ml Zauberschnee die Rede.

Bild 6: Tannenzweige, mit Zauberschnee bedeckt
(Foto: Lüttgens)
Versuch 1: Herstellung von Zauberschnee aus Natriumacrylat-Pulver
Gib einen Teelöffel (ca. 5 ml) Zauberschnee-Pulver in eine ausreichend große Schale. Gieße ca. 60 ml Wasser hinzu und beobachte. Füge bei Bedarf Wasser hinzu, um die Konsistenz des Kunstschnees zu verändern.
Ergebnis: Das Pulver quillt rasch zu einem Vielfachen seines Volumens auf. Der „Schnee“ kann nach dem Trocknen erneut verwendet werden.

Bild 7: Ein Teelöffel Zauberschnee
(Foto: Lüttgens)
Die Volumenzunahme ist wirklich beeindruckend, wie sich auf den Bildern erkennen lässt.
Klick mich an!
Bild 8: Der Zauberschnee quillt auf.
(Foto: Lüttgens)
Bild 9: Und weil´s so viel Spaß macht, wurde direkt mit dem Bau von Schneemännern angefangen.
(Foto: Habermann [5])
Worin besteht die „Zauberei“ beim Zauberschnee?
Natrium-Polyacrylat ist ein Polymer, das aus langen Molekülfäden aufgebaut ist.
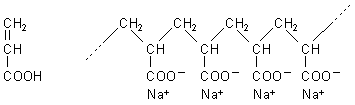
Struktur von Arcylsäure und von Natrium-Polyacrylat
Diese Fäden sind mehr oder weniger stark ineinander verknäult. In dieses Knäul können Wassermoleküle eindringen. Der Kunststoff bläht sich so auf ein Vielfaches seiner Größe auf. Das sogenannte funktionale Polymer ist ein richtiger "Wassersauger", daher auch seine Bezeichnung als Hydrogel. Diese Art von Superabsorbern wird übrigens auch in Babywindeln eingesetzt. Dort fangen sie den Urin wirksam auf, auch in größeren Mengen, bevor ein „Malheur“ passiert. Wer Genaueres zur Bildung verschiedenster Gele – so nennt man ein dreidimensionales chemisches Netzwerk einer festen Komponente, das in seine Zwischenräume eine Flüssigkeit aufnehmen kann, dem sei der Tipp des Monats September 2005 (Tipp-Nr. 99) empfohlen.
Für Spezialisten
Die Lösungsmittelteilchen – hier sind es die Wassermoleküle – diffundieren in das Knäul der Kunststofffäden ein. Einmal eingedrungen können die Dipolmoleküle des Wassers mit den Carboxyl-Anionen des Acrylat-Anions ebenso
wechselwirken wie mit den positiv geladenen Natriumionen des Salzes. Man spricht jeweils von Ion-Dipol-Wechselwirkungen. Diese zwischenmolekularen Kräfte sind ungerichtet. Da die Maschenweite der Molekülfäden zunimmt, wenn Wassermoleküle
eindringen, werden zunehmend weitere Bindungsstellen für weitere Wassermoleküle erreichbar. Die in den aufquellenden Kunststoff eindringenden Wassermoleküle können sich nun auch um die bereits von anderen Wassermolekülen „besetzten“ Bindungsstellen
anordnen und entsprechend ausrichten. Man spricht hier von sogenannten Wasserstoffbrückenbindungen, bei denen es sich um starke Dipol-Dipol-Wechselwirkungen zwischen den Wassermolekülen handelt.
Ein solches „funktionales“ Gel kann enorme Mengen an Wasser aufnehmen. Allerdings nicht beliebig viel. Da das Knäul sich zunehmend dehnt, setzt sich dieser Dehnung eine zunehmend größere Rückstellkraft entgegen. Irgendwann wird es ein Kräftegleichgewicht geben zwischen dem sich aufbauenden osmotischen Druck und der durch die Dehnung hervorgerufenen Rückstellkraft. Und dann ist Schluss [3, 4]. Weiteres hinzugegebenes Wasser führt nur dazu, dass der „Zauberschnee“ sich feucht anfühlt und zunehmend matschiger wird.
3. „Selfmade“-Schnee aus Rasierschaum und Backpulver
Ob diese Variante mit den bisher vorgestellten Kunstschneesorten mithalten kann? Ich war skeptisch.
Versuch 2: Herstellung von „Selfmade“-Schnee
In einer Schüssel werden bis zu ca. 5 Tüten Backpulver oder Natron mit der entsprechenden Menge an Rasierschaum mit einem Löffel so lange vermischt, bis eine deutliche Verklumpung einsetzt. (Hinweis: Die Dose mit Rasierschaum
muss vorher gut geschüttelt werden.)
Ergebnis: Das Gemisch aus Rasierschaum und Backpulver fällt zu einer an die Konsistenz von Schnee erinnernden Masse zusammen.

Bild 10: Der Rasierschaum wird mit dem Backpulver vermischt
(Foto: Lüttgens)
Als Erstes habe ich drei Tüten Backpulver in eine Schüssel gegeben. Das war bei der Schaummenge, die ich dazu gesprüht hatte, eindeutig zu wenig. Mit der vierten Tüte Backpulver fiel der Schaum beim Einrühren ein wenig zusammen. Beim Verrühren des Pulvers fällt ein leises, kaum hörbares Knistern auf – ein deutliches Indiz für die Entwicklung von Kohlenstoffdioxid, das aus dem Gemisch aus Rasierschaum und Backpulver durch die Reaktion des Treibmittels Natriumhydrogencarbonat (NaHCO3) mit Wasser freigesetzt wird.
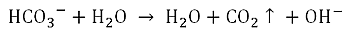
Für Spezialisten
Rasierschäume enthalten neben gesättigten Fettsäuren (Stearinsäure, Palmitinsäure) auch Tenside wie z. B. Natriumlaurylsulfat (ein anionisches Tensid) als entfettender Schaumbildner und Emulgatoren. Ein Emulgator, der ebenfalls häufig eingesetzt wird, ist Triethanolamin (Trihydroxyethylamin).
Es hält u.a. den Schaum feucht. Dieses Triol kann mit den Fettsäuren durch Veresterung zu den Triethanolaminseifen reagieren. Da das anionische Laurylsulfat-Ion mit Wasser basisch reagiert, werden – quasi nebenbei – überschüssige Fettsäuren im Rasierschaum neutralisiert.
Triethanolamin ist in der Lage Kohlenstoffdioxid zu absorbieren. Dies wird in sogenannten „Aminwäschern“ genutzt, die in der Industrie z. B. bei der Ammoniaksynthese genutzt werden, um Katalysatoren zu „entgiften“. Dabei bilden sich sogenannte Cabamate.
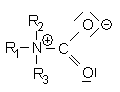
Struktur eines Carbamats
Dies könnte eventuell erklären, warum der Schaum mit der Zugabe des Backpulvers zusammenfällt und nicht weiter aufquillt, wie mit der Freisetzung des Treibmittels Kohlenstoffdioxid zu erwarten wäre.
Nicht nur der Vollständigkeit halber seien hier noch zwei weitere Alternativen genannt:
4. Zwei Ökovarianten: Schnee aus Papier und Schnee aus Maisstärke
Ob sich mit diesen beiden Varianten auch im Sommer eine Schneeballschlacht schlagen lässt, möge jeder für sich entscheiden. Jedenfalls kann man dabei ein reines Gewissen haben. Denn: Die Papier- und Maisstärkeschnipsel, aus denen der Öko-Kunstschnee besteht, lassen sich sicherlich leicht entsorgen im Vergleich zu den bisher besprochenen Kunststoff-Varianten und können daher getrost als unbedenklicher und umweltfreundlicher bezeichnet werden.

Bild 11: Tannenzweige, mit Papierschnee bzw. mit Schnee aus Maisstärke bedeckt
(Foto: Lüttgens)
Der Nachweis von Cellulose im Papierschnee

Bild 12: Die Blaufärbung zeigt die Cellulose im Papierschnee an
(Foto: Lüttgens)
Versuch 3: Nachweis von Cellulose
Gib zu einigen Flocken Papierschnee auf einem Uhrglas einige Tropfen Iod-Zinkchlorid-Lösung.
Ergebnis: Die Flocken färben sich bläulich.
Ausführlichere Informationen zum Cellulose-Nachweis finden sich hier. Wie eine Iod-Zinkchlorid-Lösung-Lösung hergestellt wird, erfährst du hier.
Für Spezialisten
Für den Papierschnee bildet Cellulose die Grundlage. Diese ist aus linearen Makromolekülen aufgebaut, die sich überwiegend parallel ausrichten und über starke Wasserstoffbrückenbindungen miteinander „verknüpft“ sind.
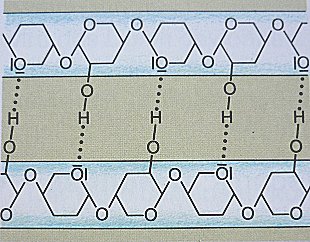
Cellulosemolekül (Ausschnitt)
Vertiefende Informationen zum Aufbau von Cellulose finden sich hier.
Der Nachweis von Stärke im Schnee aus Maisstärke

Bild 13: Der Stärkenachweis bei Maisstärke-Schnee
(Foto: Lüttgens)
Versuch 4: Nachweis von Stärke
Gib zu einigen Flocken Maisstärkeschnee auf einem Uhrglas einige Tropfen Iod-Kaliumiodid-Lösung (Lugolsche Lösung).
Ergebnis: Die Flocken färben sich intensiv bläulich.
Ausführlichere Informationen zum Stärkenachweis finden sich hier.
Für Spezialisten
Maistärke besteht zu ca. 26 % aus Amylose, dessen Makromoleküle linear gebaut sind. Diese Makromoleküle sind schraubenförmig gewunden, daher spricht man von einer Helixstruktur. In diese spiralige Raumstruktur können Iod/Iodid-Teilchen einlagern. Diese bestehen beispielsweise aus Polyiodid-Anionen [I3]-.
Erkennen können wir die Einlagerungsverbindung, die sich so bildet, an der dunkelbläulichen Färbung der Stärke. Übrigens: Auch Amylopektin reagiert mit der Iod-Lösung, allerdings eher rotviolett.
Entsorgung
Beide letztgenannten Varianten, der Kunstschnee aus Cellulose und der aus Maisstärke, haben den Charme, dass sie über den Kompost entsorgt werden können. Ein nicht zu unterschätzender Vorteil gegenüber beispielsweise dem Dekoschnee. Denn: Versuchen Sie mal, einen mit Dekoschee beladenen Weihnachtsbaum in einer Grünen Tonne oder einem Gelben Sack –
so müsste der Kunststoff fachmännisch entsorgt werden – unterzubringen.
Mein Fazit
Meine Frau konnte ich nicht überzeugen. Wir beide mögen die winterliche „Idylle“ all diese Kunstschnee-Produkte nicht, denn sie reichen an richtigen Schnee unseres Erachtens nicht heran, auch wenn sie auf den ersten Blick täuschend echt aussehen. Und es sei auch gesagt: Mit der Entsorgung schafft man sich weitere,
unnötige Probleme. Unsere Meinung daher: Wenn die Natur zu Weihnachten keinen Schnee aus eigener Kraft liefern kann, dann erfreuen wir uns gern auch an grünen Weihnachtsbäumen. Unserem familiären Weihnachtsfest tut das auf jeden Fall keinen Abbruch.
Literatur:
[1] Persönliche Mitteilung der Snow Business GmbH, Greven, Deutschland, http://www.snowbusiness.de
[2] Mögliche Bezugsquelle für professionelle Ansprüche: wintereffects.com
[3] Chemie Oberstufe, Cornelsen Schulverlage, Berlin 2010, S.466
[4] A. Göthlich, S. Koltzenburg, G. Schornick, Funktionale Polymere im Alltag, Chemie in unserer Zeit 2005 (39), S.262 ff
[5] Das Bild wurde freundlicherweise von Frau Dr. Habermann zur Verfügung gestellt.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 1. Dezember 2016, Fritz Meiners

