Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Oktober 2017 (Tipp-Nr. 244)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Atemkalk – Chemie im Rettungsgerät und beim Tauchen!
Jens Schorn
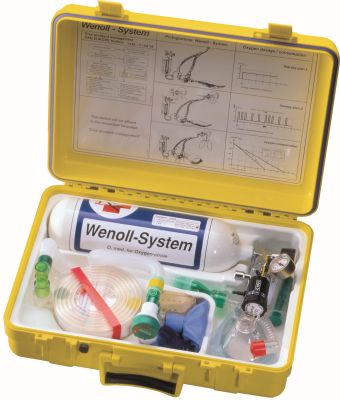
Menschen mit eingeschränkter Lungenfunktion oder nach einem Tauchunfall, sogenannten Dekompressionsunfällen oder Lungenüberdruckunfällen, sind auf eine Sauerstoffversorgung über ein Beatmungsgerät angewiesen. Das benötigte Atemgas wird dem Patienten oder Verunglücktem dann aus einer Druckflasche mit medizinischem Sauerstoff zur Verfügung gestellt. Gegenüber medizinischem Sauerstoff wird sogenannter technischer Sauerstoff (z.B. zum Schweißen oder in der Lebensmitteltechnik) in Flaschen mit blauem Mantel verwendet. Der Inhalt der Flaschen ist gleich. Lediglich der Einsatz unterscheidet sich. Klick mich an! Bild 1: Medizinischer Sauerstoff (oben quer) in einem Sauerstoff-Notfallkoffer WS 100 der Firma EMS GmbH
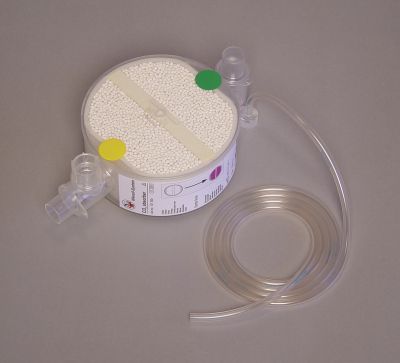
Erstaunlicherweise findet man in einem solchen Koffer neben der Quelle für den Sauerstoff in der Gasflasche noch einen Kunststoffbehälter mit einem weißen Granulat, sogenanntem Atemkalk. Klick mich an! Bild 2: Kartusche mit Atemkalk aus einem Sauerstoff-Notfallkoffer der Firma EMS GmbH
Wozu dient dieser Atemkalk?
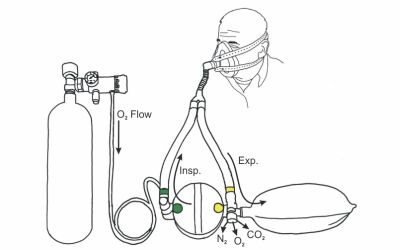
Klick mich an! Bild 3: Schema des Kreislaufsystems mit Atemkalkkartusche in der Mitte mit den farbigen Markierungen
Bei der Anwendung des Geräts wird der Sauerstoff aus der Gasflasche (links) in den Kreislauf eingeleitet und dem Patienten zugeführt. Durch die Atmung wird in der Lunge des Patienten der Sauerstoff gegen Kohlenstoffdioxid ausgetauscht und beim Ausatmen in den Ausatembeutel, eine sogenannte Gegenlunge (rechts in der Abbildung), geblasen. Beim nächsten Atemzug des Patienten wird nun das ausgeatmete Gasvolumen aus dem Ausatembeutel über die Atemkalkkartusche (unten zwischen den beiden Hauptschläuchen liegend) wieder im Kreislauf mit neuem Sauerstoff ergänzt und dem Patienten erneut zugeführt. Damit beim Einatmen in einem solchen Notfallkoffer kein Kohlenstoffdioxid eingeatmet wird, muss das Kohlenstoffdioxid aus dem Ausatemgas entfernt werden. Der ausgeatmete Wasserdampf wird bis zu einem gewissen Anteil in der Kartusche gebunden. Der verbrauchte Sauerstoff wird über einen Druckregler entsprechend nachdosiert und ergänzt. Kohlenstoffdioxid wird durch den Atemkalk, der aus Natriumhydroxid (NaOH), Calciumhydroxid (Ca(OH)2) und einer gewissen Restfeuchtigkeit (Wasser) besteht, in den folgenden drei Schritten chemisch gebunden. Durch algebraische Addition der Gleichungen (1) bis (3) erhält man die Gleichung für die Gesamtreaktion: Das entstehende Kohlenstoffdioxid bildet zusammen mit der Restfeuchtigkeit (Wasser) des Atemkalks Kohlensäure (1). Anschließend entstehen aus Kohlensäure und Natriumhydroxid Natriumcarbonat und Wasser (2). Zum Schluss bildet Natriumcarbonat mit Calciumhydroxid, dem Hauptbestandteil des Atemkalks, die Produkte Calciumcarbonat und Natriumhydroxid (3). Sowohl Natriumhydroxid wie auch Wasser müssen im Atemkalk nur in geringen Mengen vorhanden sein, da sie in den Gleichungen (3) bzw. (2) als Produkte hervorgehen und dann wieder als Edukte in Gleichung (2) und (1) verwendet werden. Das Gasgemisch für den nächsten Atemzug ist auf diese Weise vom Kohlenstoffdioxid befreit. Das Gas wird also vom Atemkalk absorbiert. Man spricht von Chemisorption. Die Reaktionen (1) und (2) sind exotherm, während die 3. Reaktion endotherm ist. Die Gesamtreaktion (4) ist deshalb exotherm. Anhand eines einfachen Experiments mit käuflichem Atemkalk kann man diesen Vorgang nachvollziehen. Hierbei kann man die Temperaturzunahme der insgesamt exotherm ablaufenden Reaktionen messen. Außerdem kann man dabei beobachten, wie das Kohlenstoffdioxidgas im Laufe der Zeit gebunden wird. Versuch 1: Reaktion von Atemkalk mit Kohlenstoffdioxid 10 ml käuflichen Atemkalk (Bezugsquelle: UNlimited-world trade union GmbH) füllt man in eine Einwegspritze ohne Kolben. Über das eine Spritzenende stülpt man einen Ballon, der mit ca. 1 l Kohlenstoffdioxid gefüllt ist und einer Schlauchklemme verschlossen ist. Das hintere Ende der Spritze wird mit einem weiteren Luftballon verschlossen. Klick mich an! Bild 4: Experiment 1
Nun entfernt man die Schlauchklemme. Das Gas strömt sofort in den leeren Ballon und strömt durch Pumpbewegungen des kleineren Ballons immer wieder über den Atemkalk. Klick mich an! Video: Experiment 1
Man beobachtet folgende Dinge:
Klick mich an! Bild 5: Endvolumen Experiment 1. Mit Bild 4 vergleichen
Klick mich an! Bild 6: Temperaturmessung des Atemkalks
Klick mich an! Bild 7: Kondensatbildung und Verfärbung des Atemkalks
Erklärung:
Die Inhaltsangaben auf dem Atemkalk geben den Hinweis, dass es sich bei dem Indikator um Ethylviolett handelt [4]. Klick mich an! Bild 8: Inhaltsangaben des Atemkalks
Der Indikator wird dem Atemkalk beigemischt, um eine grobe Einschätzung über die verbleibende Aufnahmekapazität des Atemkalks treffen zu können. Eine solch grobe Einschätzung ist für die Anwendung im Tauchsport nicht hinreichend, da man hier genau wissen muss, ab welchem Moment kein Kohlenstoffdioxid gebunden wird.
(Foto: Mit freundlicher Genehmigung durch EMS GmbH Emergency Medical Systems CEO Klaus Voll)
(Foto: Mit freundlicher Genehmigung durch EMS GmbH Emergency Medical Systems CEO Klaus Voll)
Sieht man sich in der Gebrauchsanweisung eines Notfallkoffers das folgende Schema an, so stellt man fest, dass sich der Atemkalk in der Kunststoffkartusche in einem Kreislauf befindet.
(Piktogramm: Mit freundlicher Genehmigung durch EMS GmbH Emergency Medical Systems CEO Klaus Voll)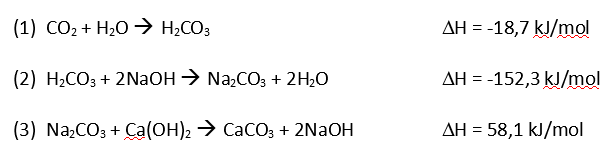
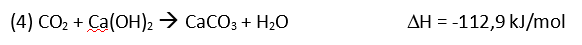
(Foto: Schorn)
(Video: Schorn)
(Foto: Schorn)
(Foto: Schorn)
(Foto: Schorn)
(Foto: Schorn)
Wie funktioniert ein Kreislauftauchgerät mit Atemkalk?
Ähnlich wie bei dem Sauerstoffnotfallkoffer atmet der Taucher die Ausatemluft in eine Gegenlunge. Dabei wird das Gas durch den Atemkalkbehälter geleitet und das Kohlenstoffdioxid chemisch gebunden. Der verbrauchte Sauerstoff wird entweder aus einer Gasflasche oder wie z. B. bei Regenerationsgeräten für Feuerwehreinsätze aus Feststoffen wie Natriumchlorat oder Kaliumhyperoxid ersetzt.
Kaliumhyperoxid reagiert mit Kohlenstoffdioxid und Wasserdampf unter Bildung von Kaliumhydrogencarbonat und Sauerstoff.
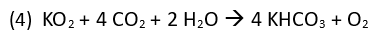
Im Gegensatz zu offenen Drucktauchgeräten (DTG) [1], bei denen das vollständige Gasgemisch aus einer Druckgasflasche entnommen wird, liegt der große Vorteil dieser geschlossenen Kreislaufgeräte darin, dass nur der verbrauchte Sauerstoff ergänzt werden muss. Der Hauptteil der Gasmischung zirkuliert und wird wieder eingeatmet. Wichtig ist ja stets der gleichbleibende Partialdruck des Sauerstoffs von 0,21 bar in dem Atemgasgemisch, das eingeatmet wird. Diese Technologie wird übrigens auch für die Belüftung von U-Booten eingesetzt.
Dem geneigten Taucher stellt sich damit die Frage, wie lange er mit einem solchen Kreislaufatemgerät tauchen kann. Oder chemisch gefragt:
Wie viel Kohlenstoffdioxid kann gebunden werden und wie kann man messen, ob der Atemkalk noch verwendet werden kann?
Eine Möglichkeit wäre, die Aufnahmekapazität auf der Grundlage der Massenzunahme bei der Absorption von Kohlenstoffdioxid abzuschätzen.
Hierzu eine kleine Rechnung:
-
Wieviel Kohlenstoffdioxid wird von 1 kg Atemkalk gebunden?
Betrachtet man die Gleichung (1-3) zur Absorption von Kohlenstoffdioxid, so stehen die Stoffmengen von Kohlenstoffdioxid (CO2) und dem Endprodukt Calciumcarbonat (CaCO3) im Verhältnis 1:1.
Geht man davon aus, dass 80 % des Atemkalks aus Calciumhydroxid bestehen [4], so lässt sich leicht berechnen, wieviel Kohlenstoffdioxid von einem Kilo Atemkalk theoretisch gebunden werden kann.
1 kg Atemkalk enthält 800 g Calciumhydroxid.
Mit dem Verhältnis zwischen der Stoffmenge, der Masse und der Molmasse von Calciumhydroxid (74 g/mol) erhält man die Stoffmenge an Kohlenstoffdioxid die von 1 kg Atemkalk theoretisch gebunden werden kann.
n = m/M
n = 750 g/ 74 g/mol = 10,1 mol.1 kg Atemkalk bindet bei 20 °C 10,1 mol Kohlenstoffdioxid.
-
Um sich das räumlich besser vorstellen zu können, kann man das Volumen einfach berechnen. Mit dem Verhältnis zwischen der Stoffmenge, dem Volumen und dem Molvolumen für Gase erhält man das Volumen an Kohlenstoffdioxid, das von 1kg Atemkalk theoretisch gebunden werden kann.
n = V/Vm bzw. n*Vm=V
V= 10,1 mol*22,4 l/mol = 226,24 l1 kg Atemkalk bindet bei 20 °C 226 l Kohlenstoffdioxid.
-
Mit dem Verhältnis aus der Molmasse von Kohlenstoffdioxid (44 g/mol) und der ermittelten Stoffmenge erhält man die Masse des gebundenen Kohlenstoffdioxids
m = n*M
m = 10,1 mol*44 g/mol=444 g1 kg Atemkalk würde theoretisch bei vollständiger Absorption von 226 l CO2 um 444 g schwerer werden. Das entspräche einer Massenzunahme von 44 %.
Beim Tauchen könnte man also vor dem Tauchgang die Atemkalkpatrone einfach auf eine Waage stellen und die bekannte Ausgangsmasse von frischem Atemkalk (ca. 2,5 kg) abziehen. Die Differenz ergäbe dann die noch bestehende Aufnahmekapazität des Atemkalks.
Das kann man in einem einfachen Experiment leicht nachprüfen.
|
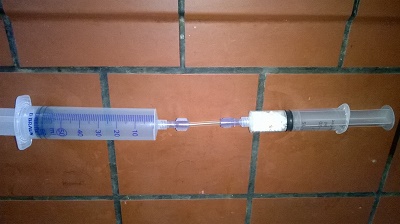
Versuch 2: Quantitative Messung der Absorption von Kohlenstoffdioxid durch Atemkalk Man wiegt ca. 6 g Atemkalk ab und füllt diesen in eine trockene 20 ml Spritze. Klick mich an! Bild 9 und 10: Abwiegen von Atemkalk (links) & Mit Atemkalk befüllt Spritze (rechts)
Anschließend verbindet man diese Spritze mit einer weiteren mit Kohlendioxid gefüllten Spritze. Klick mich an! Bild 11: Fertiger Versuchsaufbau
Nun schiebt man das Kohlendioxid aus der einen Spritze in die andere herüber, sodass der Atemkalk mit dem Kohlenstoffdioxid umspült wird. Dies wiederholt man mit mehreren Spritzenfüllungen bis zur Blaufärbung des Atemkalks. In den Beispielmessungen erhält man lediglich eine Massenzunahme von maximal 19 % bei einer Absorption von max. 800 ml Kohlenstoffdioxid für die eingesetzte Masse an Atemkalk. |
Woran liegt das?
Betrachtet man sich den Atemkalk genauer, so stellt man fest, dass es sich hierbei um ein grobkörniges Granulat handelt.
Klick mich an!
Bild 12: Atemkalk vergrößert. Durchmesser der Kügelchen 2,5-3 mm
(Foto: Schorn)
Die Oberfläche spielt bei der Absorption von CO2 eine entscheidende Rolle.
Zerkleinert man den Atemkalk in einem Mörser, so lassen sich in dem Experiment größere Mengen an Kohlenstoffdioxid absorbieren. Läge der Atemkalk aber als Pulver vor, so würde das Atemgas nicht schnell genug durch den Kalk hindurch gelangen und der Atemfluss im Kreislaufatemgerät wäre gestört oder sogar blockiert.
Also ist die Messung der Massendifferenz zur Einschätzung der Absorptionskapazität nicht gut geeignet. Außerdem kommt noch hinzu, dass unsere Ausatemluft erhebliche Menge an Wasserdampf enthält, der durch den Atemkalk ebenfalls gebunden wird und zu einer verfälschenden Massenzunahme führen würde. Das ist für einen sicheren Tauchgang nicht nützlich.
Laut Angaben gängiger Atemkalkhersteller absorbiert 1 kg Atemkalk 120 Liter CO2.
Die Dauer eines Tauchgangs bei dem in einem Kreislaufatemgerät 2 kg Atemkalk verwendet werden, hängt dann vom Atemminutenvolumen und dem Belastungszustand während des Tauchgangs ab [1].
Ausatemluft enthält zwischen 4,3-5,7 Vol-% Kohlenstoffdioxid. Bei einem normalen Atemminutenvolumen von 20 l/min würden 940-1140 ml CO2 entstehen, also ca. 1 l/min.
Damit sind Tauchgänge bis zu 240 Minuten möglich, was der Praxis entspricht.
Wie wird die Kapazität von Atemkalk nun in der Tauchpraxis eingeschätzt?
Hier macht man sich die insgesamt exotherme Reaktion (siehe oben in Gleichung (4)) des Atemkalks nützlich. Läuft die Reaktionen ab, so ergibt sich eine kontinuierliche Wärmeentwicklung im System. Ein Temperaturmessstab vergleicht die Temperaturverteilungen im gesamten Kalkbehälter und zeigt präzise die chemische Aktivität im Kalk an. Dies wird dem Taucher dann auf einem elektronischen Display angezeigt. Sinkt die Temperatur unter einen kritischen Wert, dann laufen die Reaktionen zur Absorption von Kohlenstoffdioxid nicht mehr ab. Kohlenstoffdioxid würde sich anreichern, und damit heißt es auftauchen und neuen Kalk tanken.
Quellen:
[1] Thomas Kromp, Hanjo Roggenbach, Peter Bredebusch: Praxis des Tauchens; Gebundene Ausgabe; Edition Naglschmid; 7. Neuauflage 2014; Stuttgart
[2] http://www.wenoll-system.de/sites/default/files/CO2-Absorber_D_1.pdf
[3] https://www.c2med.de/media/files_public/e455f8ee904c2032354dc6e53b351ce9/Sicherheitsdatenblatt%20SPHERASORB%20im%20Kanister.pdf
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 1. Oktober 2017, Fritz Meiners