Prof. Blumes Bildungsserver für Chemie
Tipp des Monats März 2016 (Tipp-Nr. 225)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Warum verbrennen kleine Holzscheite schneller als große? - Chemische Reaktionen an Grenzflächen
Rüdiger Blume
Beim gemütlichen Sitzen vor dem Kaminfeuer kommt die Frage auf, warum Kleinholz schneller verbrennt als große Stücke, welche bekanntlich stundenlang vor sich hinglühen können. Bild 1: Kaminfeuer

(Foto: Blume)
Wir führen ein Gedanken-Experiment durch
Wir vergleichen die Verbrennung gleich schwerer Mengen von unterschiedlich zerkleinertem Holz.
Das Beobachtete hat deutlich etwas mit der Größe der Oberfläche zu tun, also mit dem Zerteilungsgrad. Denn die Verbrennung, um die es hier geht, ist bekanntlich eine chemische Reaktion zwischen gasförmigem Sauerstoff und dem festen Holz. Je größer die Oberfläche des Festkörpers ist, desto mehr Sauerstoff kann angreifen, desto heftiger verbrennt das Holz.
Ein praktischer Vergleich von Oberflächengrößen
Das mit dem Zerteilungsgrad können wir selbst untersuchen.
Für das Experiment wählen wir zwei Gruppen von Holzstücken wie im folgenden Bild aus. Dabei achten wir darauf, gleiche Holzarten zu verwenden. Durch Abwiegen sorgen wir dafür, dass die Massen der beiden Gruppen ungefähr gleich sind.

Bild 2: Zwei Portionen mit gleichen Massen von Koniferenholz-Scheiten
(Foto: Blume)
Das Bild zeigt jeweils 1750 g Koniferenholz, einmal als groben Klotz, das andere Mal in Form 11 kleiner Ast-Stücke.
Wie groß die Oberflächen der beiden Holzproben sind, kann man überschlägig selbst ausrechnen, denn der Klotz und die Scheite stellen näherungsweise Zylinder dar. Die Oberfläche eines Zylinders mit dem Radius r und der Höhe h berechnet man wie folgt:
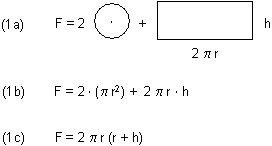
Beim großen Block kann man Durchmesser bzw. Radius sowie Länge leicht ausmessen. Aufwendiger ist das bei den kleinen Ast-Stücken. Da muss man die jeweiligen Durchmesser und Längen messen und aus deren Summen Mittelwerte bilden, indem man sie durch die Zahl der Stücke teilt.
Unsere Messungen und Berechnungen ergaben:
Holzblock: Radius 6,75 cm; Länge 26 cm
(2a) FBI = 13,5 · π (6,75 + 26) = 1388 cm2
Holzscheite: Radius 1,6 cm; Länge 30 cm (Mittelwerte über 11 Stücke)
(2b) FHS = 11 · 3,2 · π (1,6 + 30) = 3493 cm2
Das Verhältnis der Oberflächen beträgt:
(2c) FHS / FBI = 2,52
Bei gleicher Masse haben die 11 kleinen Holzscheite also eine mehr als 2,5 mal größere Oberfläche als der dicke Holzblock.
Das könnte das schnellere Abbrennen der kleinen Stücke erklären.
Nun steht der Brennprobe im häuslichen Kamin nichts mehr im Wege
Der Kamin wird angefeuert und die erste Füllung so weit niedergebrannt, dass sie ein gutes Glutbett bildet und nachgelegtes Holz zu brennen beginnt. Dann legen wir zuerst die elf kleinen Ast-Stücke hinein und beobachten deren Brennverhalten. Wenn sie weitgehend abgebrannt sind, legen wir den groben Klotz ins neue Glutbett.

Bild 3: : Blick in den Kaminofen: Wie unterschiedlich zerteiltes Holz brennt.
Links elf Ast-Stücke, rechts ein grober Klotz
(Fotos: Blume)
Ergebnis: Während die kleinen Scheite nach kurzem Anbrennen innerhalb einer halben Stunde weitgehend aufgebrannt sind, kokelt der Klotz mehr als zwei Stunden vor sich hin, bis auch er sich unter Hinterlassen von ein wenig Asche in Rauch „aufgelöst“ hat.
Die gleichen Überlegungen…
… wie für das Verbrennen von Holz gelten letztlich auch für das Verbrennen von unedlen Metallen wie Aluminium, Magnesium und Eisen.
Aber auch das Lösen von Zucker oder Salzen folgt ähnlichen Gesetzmäßigkeiten. Hier geht es allerdings um die Wechselwirkung zwischen einer Flüssigkeit (Wasser) und einem Festkörper, wobei die Wassermoleküle das Kristallgitter angreifen. Ein für die Schule geeignetes Beispiel ist der Vergleich der Löslichkeit von großen Zuckerkristallen (Kandis oder „Kluntjes“), normalem kristallinem Haushaltszucker und Puderzucker.
Man kann natürlich auch ein Salz nehmen – wie zum Beispiel Kupfer(II)-sulfat-pentahydrat („Kupfervitriol“). Davon lassen sich leicht große Kristalle züchten.
Ein weiteres Beispiel für die Wechselwirkung zwischen Flüssigkeiten und unterschiedlich zerteilten Festkörpern ist das Zersetzen von Metallen durch Säuren. (Den Begriff „Lösen“ sollte man hier unbedingt vermeiden, da es sich beim Lösen von Zucker und Salzen um einen reversiblen physikalischen Vorgang, beim Zersetzen von Metallen in Säuren jedoch um eine chemische Reaktion (Redox-Reaktion) handelt.)
Hinweis für Spezialisten
Bei unseren Überlegungen begegnen wir einem Grundgesetz der Chemie, das die Rolle der Oberflächen bei Reaktionen zwischen Festkörpern und gasförmigen oder flüssigen Stoffen betrifft.
Zunächst einige Definitionen: Die Räume, die durch Oberflächen gegeneinander abgegrenzt sind, nennt man Phasen. Es gibt feste, flüssige oder gasförmige Phasen. Die Oberflächen, an denen sich die Phasen berühren, heißen Phasengrenzen oder auch Grenzflächen und Kontaktflächen. Die Größe der Oberflächen hängt vom Zerteilungsgrad ab. Zur Verdeutlichung der Zunahme der Oberfläche beim Zerkleinern von Körpern haben wir eine Webseite mit dem Beispiel eines Würfels.
Das Gesetz lautet: Die Geschwindigkeit von Reaktionen an Phasengrenzen ist eine Funktion der Größe der Kontaktflächen.
Kontaktflächen spielen eine große Rolle in der Technik der Katalyse. Das betrifft vor allem die heterogene Katalyse; beim heterogenen Katalysator spricht man auch von Kontakten.
Die Größe der Grenzflächen spielt auch in der chemischen Energetik eine wichtige Rolle. Sie bestimmt mit über das so genannte Chemische Potential eines Stoffes. Das wiederum ist wichtig für die Berechnung von Freien Energien.
Welch große Kräfte und Energie-Mengen zwischen zwei Phasen an den Grenzflächen auftreten können, beschreiben wir am Beispiel der Oberflächenspannung von Wasser.
Zum Schluss
Warum wird beim Verbrennen anscheinend mehr Energie frei, wenn die kleinen Scheite verbrennen? Es sollte doch so sein, dass die freigesetzte Energie für gleiche Massen gleich groß ist – egal, ob die Substanz grob oder fein zerteilt vorliegt.
Um zu verstehen, warum die kleinen Scheite beim raschen Verbrennen so viel Hitze entwickeln, sollte man sich verdeutlichen, dass hier der Quotient Energie/Zeit, also die Leistung die zentrale Rolle spielt. Die Leistung hängt sehr wohl vom Zerteilungsgrad ab. Denn je feiner zerteilt das brennbare Material vorliegt, desto geringer ist die Brenndauer, aber desto größer ist die Leistung.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 02. März 2016, Fritz Meiners