Prof. Blumes Tipp des Monats September 2014 (Tipp-Nr. 207)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wasser hat eine dicke Haut
Jetzt sieht man sie wieder: Die Wasserläufer, die rasch über Pfützen und Teiche flitzen.
Klick mich an!
Bild 1: Wasserläufer
(Foto: Blume)
Viele Betrachter fragen sich, warum diese Wasserwanzen (Gerridae) nicht einsinken. Es
sieht so aus, als liefen sie auf einer ausgespannten Folie.
Man kann Erklärungen versuchen: Zum einen sind die Tiere sehr leicht. Das ist aber nicht der Grund für das Nichteinsinken. Denn wenn man genau hinschaut, erkennt man, dass sie so schwer sind, dass sie sogar Dellen (Beulen) ins Wasser drücken. Das festzuhalten ist wichtig für die Erklärung des Phänomens.
Wichtig scheint auch folgendes: Die Oberfläche der Wasserläufer besteht aus dem stark wasserabweisenden Chitin. Die Füßchen der Tiere sind dazu noch kräftig behaart. Die feinen Härchen bilden dichte Pelze, die große Mengen an Luft einzulagern vermögen.
Die Oberfläche des Wassers trägt aber auch eine Rasierklinge - die hat bekanntlich keine Härchen.
|
Versuch 1: Die schwimmende Rasierklinge
|
Klick mich an!
Bild 2: Schwimmende Rasierklinge
(Foto: Blume)
Auch bei der schwimmenden Rasierklinge erkennt man die Einbeulung der Wasseroberfläche.
Was verbindet Wasserläufer und die Rasierklinge? Letztere ist zwar wesentlich schwerer. Beide haben aber eine nicht benetzbare Oberfläche - die besteht einmal aus Chitin und das andere Mal aus Metall.
Um das Phänomen der Oberflächenspannung zu verstehen, …
… muss man sich wieder einmal auf die molekulare Ebene begeben. Wasser besteht aus Molekülen, die aufgrund von
Wasserstoffbrücken zusammengehalten werden.
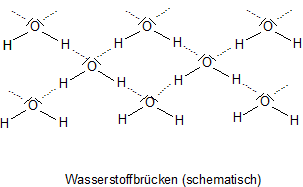
Ihre Bindungsenergie ist etwa 1/3 so groß wie „normale“ chemische Bindungsenergie. Das ist erstaunlich viel. Bedenkt man aber,
dass es sich um elektrische Dipolkräfte zwischen polaren Molekülen handelt, ist das nicht überraschend.
Beim Beschreiben von Flüssigkeiten tauchen stets zwei Begriffe auf:
Die Viskosität (Zähigkeit) einer Flüssigkeit gibt Aufschluss über den Zusammenhalt der Moleküle innerhalb der flüssigen Phase. Sie behindert das Fließen der Flüssigkeit und wirkt in der ganzen flüssigen Phase.
Die Oberflächenspannung (auch Grenzflächenspannung genannt) ist an der Grenze („Phasengrenze“) zwischen nicht mischbaren Phasen wie Luft und Flüssigkeit lokalisiert. Sie wirkt parallel zur Oberfläche.
Mit der folgenden schematische Skizze, die man oft sieht, verdeutlicht man die Verhältnisse auf molekularer Ebene. Dargestellt sind nicht nur die möglichen Wasserstoffbrücken, sondern die allgemeine Möglichkeiten zur intermolekularen Anziehung, also auch die elektrostatischen Wechselwirkungen von Dipolmolekülen.
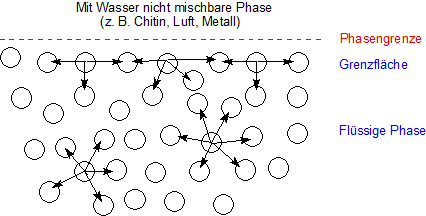
Man erkennt, dass die Oberflächenmoleküle weniger gebunden sind als diejenigen, die im Inneren der Flüssigkeit liegen.
Der unbefangene Betrachter fragt sich deshalb, wieso gerade die weniger gebundenen Moleküle einen derartigen Zusammenhalt aufweisen.
Die Moleküle im Inneren der flüssigen Phase unterliegen einer gleichmäßigen Anziehung in alle Richtungen. Die Moleküle in der Grenzflächenschicht dagegen werden einseitig ins Innere der flüssigen Phase gezogen. Daraus resultiert insgesamt ein Zug parallel zur Oberfläche und dazu noch nach Innen, weshalb Flüssigkeiten eine Oberfläche einnehmen, die so klein wie nur möglich ist.
Man kann aber auch anders, nämlich energetisch argumentieren: Da die Wasserstoffbrücken der Grenzflächen-Moleküle nicht abgesättigt sind, besitzt die Oberfläche eine größere potentielle Energie als das Flüssigkeitsinnere. Dies ist die so genannte Oberflächen-Energie, eine Form der Freien Energie.
Die Tendenz natürlicher Systeme ist nun, dass sie ihre potentielle Energie gleichmäßig verteilen bzw. minimieren müssen. Das wird bei Flüssigkeiten erreicht, indem die Oberfläche verkleinert wird.
Aus diesem Grunde bilden frei fallende Flüssigkeiten kugelförmige Tropfen. (Denn die Kugel ist bekanntlich derjenige geometrische Körper, der bei einem gegebenen Volumen die minimale Oberfläche hat.)

Bild 3: Ein Regentropfen, der auf eine gewachste Oberfläche gefallen ist
(Foto: Blume)
Bei Flüssigkeiten in Gefäßen führt das zur Bildung von gewölbten Oberflächen.
Wenn man nun einen nicht benetzbaren Körper auf die Oberfläche legt, sinkt er zunächst etwas ein. Das erkennen wir als Ausbeulen der Oberfläche (Bild 1 und Bild 2). Damit wird Oberfläche erzeugt. Das führt zum Anstieg der potentiellen Oberflächenenergie. Deshalb wehrt sich das System und stemmt sich quasi gegen das weitere Eindringen. Der Körper sinkt nicht ein. Das funktioniert aber natürlich nur, wenn seine Gewichtskraft nicht zu groß ist, um die Oberflächenspannung zu überwinden. Energetisch formuliert bedeutet das: Die potentielle Energie (die Energie der Lage) des schwimmenden Körpers darf die potentielle Energie der Grenzfläche (die Grenzflächen-Energie) nicht übertreffen.
Dabei ist die Oberflächenenergie erstaunlich klein. Sie beträgt bei 20 °C nur 7,3 · 10-6 Joule/cm2. Da die Energie auf eine andere Größe (hier die Fläche) bezogen ist, sprechen wir von der spezifischen Oberflächenenergie.
Warum aber geht das Blatt Papier, das wir zum Einbringen der Rasierklinge benötigen, unter? Papier besteht im Allgemeinen aus Cellulose. Anders als Metall oder Chitin ist Cellulose nicht wasserabweisend, sondern bildet Wasserstoffbrücken zu Wassermolekülen aus und ist somit benetzbar.
Die Oberflächenspannung wird durch Bewegen und durch Temperaturerhöhung gestört.
|
Versuch 2: Störung der Oberflächenspannung
|
Störend auf die Oberflächenspannung wirken auch Tenside. Der Begriff beruht auf dem lateinischen Wort
tentigo, Spannung.
|
Versuch 3: Die Wirkung von Tensiden
|
Tenside bestehen aus stark polaren Molekülen, die blitzschnell die Oberfläche des
Wassers besetzen. Daher nennt man sie auch grenzflächenaktive Substanzen. Das erkennt man daran, dass sie den
schwimmenden Gegenstand geradezu rücksichtslos zur Seite schieben. Dabei wird auch deutlich, in welchem Umfang Energie bei dieser Aktion
freigesetzt wird. Die Veränderung der Oberfläche des Wassers führt auch dazu, dass die Oberflächenspannung zusammenbricht und der
schwimmende Gegenstand untergeht.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 11. März 2015, Dagmar Wiechoczek

