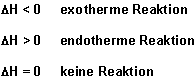
Warum laufen manche endotherme Prozesse überhaupt spontan
ab? - Die Freie Enthalpie
Experimente:
Versuch: Metalle reagieren mit Schwefel
Versuch: Abkühlung beim Lösen von Salzen
Versuch: Die exergone Reaktion zwischen festem Bariumhydroxid und
Ammoniumthiocyanat
Früher sagte man: Eine Reaktion läuft dann von alleine ab, wenn Reaktionsenergie
(Reaktionswärme, Reaktionsenthalpie DH) frei wird; also gilt
das nur für exotherme Prozesse. Da bei exothermen Prozessen das Reaktionssystem Energie an die
Umgebung verliert, bekommt die Energieänderung DH ein negatives Vorzeichen.
Allgemein gilt:
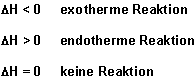
Es galt lange Zeit der Spruch: Je größer die Reaktionsenergie, desto heftiger die Reaktion, desto größer die Affinität der Reaktanden.
Bald gab es aber Widersprüche:
So lösen sich viele Salze problemlos in kaltem Wasser, obwohl dazu Energie
nötig ist (-> Versuch Lösen von Salz).
Die Salzteilchen müssen schließlich von den Wasserdipolen aus dem
Kristallgitter gelöst werden. Die Erklärung: Das Energie verzehrende Lösen der
Kristalle läuft auf Kosten der Umgebung: Die Lösung kühlt sich stark ab.
Es gibt auch wesentlich kompliziertere, aber uns persönlich betreffende Beispiele: Wie kommt es zum Aufbau von Ordnungsinseln in einer ansonsten generell chaotischen Umwelt - zum Beispiel zum Aufbau von lebenden Individuen, die im Verlaufe der Evolution immer komplexer werden? Dazu gibt es einen Hinweis: Ein kleiner Vogel muss drei bis vier Mal soviel an lebender Materie (Raupen, Samen...) verzehren, um überleben zu können. Offenbar muss er ein Vielfaches an Ordnung vernichten, um seine eigene kleine Ordnung aufzubauen und für die kurze Zeitspanne seines Lebens aufrechtzuerhalten. Das gilt für alle Lebewesen!
Warum also laufen viele endotherme Prozesse spontan ab, ohne
dass bewusst Energie zugeführt wird?
Die Antwort ist: Man darf nicht nur die Reaktionswärme (Reaktions-Enthalpie,
Symbol H) einer bestimmten chemischen Reaktion betrachten, sondern muss
auch andere Effekte einbeziehen. Hier ist vor allem die Schaffung von Ordnung
oder Unordnung in Betracht zu ziehen. Diesen Effekt drückt man durch eine von
der Energie abgeleitete Größe aus, die Entropie (Symbol S).
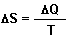
Zusammen mit der Reaktionswärme gibt es folgende Beziehung, die unter der Bezeichnung Gibbs-Helmholtzscher Satz bekannt ist. Der definiert die Änderung (Symbol D) der (Gibbsschen) Freien Enthalpie (Symbol G) im Verlaufe einer chemischen Reaktion:
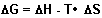
Die Freie Enthalpie eines Systems setzt sich somit zusammen aus der klassischen
Reaktionsenthalpie DH sowie aus der Entropieänderung DS
(letztere multipliziert mit der Arbeitstemperatur T) des betrachteten Systems. DG
ist derjenige Anteil an hochwertiger Energie, der zur Arbeitsleitung herangezogen werden kann.
Der Gibbs-Helmholtzsche Satz beschreibt die alltägliche Erfahrung, dass die
tatsächlich verfügbare Energie DG immer etwas kleiner ist als die theoretisch
mögliche Menge an freigesetzter Reaktionsenergie DH, da immer einiges
(ausgedrückt durch T · DS) durch Reibungsverluste
(metastabile Systeme!), durch entstehende Unordnung oder durch elektrochemische Überspannungseffekte
verloren geht.
Ist DG negativ, verliert das System Energie - das ist wie beim exothermen Vorgang. Um das deutlich abzugrenzen, sprechen wir hier von einem exergonen Vorgang. Das Gegenteil ist der endergone Vorgang. Es gilt:
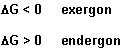
Und was ist bei DG = 0? Dann haben wir einen Gleichgewichtszustand, aus dem heraus keine Reaktion mehr erfolgt.

Damit wird auch deutlich, was DG ist: Die Freie Enthalpie beschreibt eine Art von Spannungszustand wie den einer mechanischen Feder. Ein solches System kann Arbeit leisten. Es handelt sich um ein Potential. Es ist sicherlich nicht falsch, wenn wir DG auch mit einer elektrischen Spannung wie zum Beispiel beim Zustandekommen eines galvanischen Elements vergleichen. Den entsprechenden Zusammenhang gibt es tatsächlich:
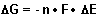
(n ist die Zahl der übertragenen Elektronen, F die Faraday-Konstante und DE die elektromotorische Kraft oder näherungsweise die Klemmspannung eines galvanischen Elements.)
Einige Beispiele, bei denen die Freie Enthalpie eine zentrale
Rolle spielt
| 1) | Beim Lösen von vielen Salzen ist die Lösungsenthalpie DH positiv. Der Prozess ist also endotherm. Weil aber die hoch geordneten Ionen aus dem Gitter gelöst werden, nimmt die Unordnung zu. Hier wird der Term T · DS bestimmend, so dass DG negativ wird. |
| 2) | Gerade in der Biochemie laufen viele Prozesse ab, die endergon sind. Sie werden mit deutlich exergonen Prozessen gekoppelt, so dass der Gesamtprozess wieder exergon ist. Eine solche exergone Hilfsreaktion ist die Hydrolyse von ATP. |
| 3) | Beim chemischen Gleichgewicht wird die Steuerbarkeit chemischer Reaktionen durch konzentrationsbedingte Variation der Freien Energie deutlich. So lässt sich ein Zusammenhang zwischen Massenwirkungsgesetz und DG herstellen, der die Prinzipien der Freien Energie deutlich werden lässt. |
| 4) | Lebewesen, bei denen DG = 0 wird, sterben. Das
heißt aber nicht, dass sie im chemischen Sinne tot sind. Sie können nur keine biologisch sinnvolle Arbeit mehr verrichten.
In ihnen laufen weiterhin all jene exothermen Prozesse (DH < O) ab, die keine
Zufuhr von Energie mehr benötigen. (Wo sollte die auch herkommen?) Das sind vor allem die abbauenden,
die hydrolytischen Reaktionen. Denn die körpereigenen Substanzen wie Proteine, Polysaccharide, Nukleinsäuren
und Ester befinden sich auf hohem chemischen Potential, da bei ihrer Herstellung viel Freie Enthalpie in der
stofflichen Form von ATP investiert und somit gespeichert wurde. Zwar sind diese Verbindungen in
Gegenwart von Wasser metastabil, aber vergessen wir nicht, dass es in den Zellen noch die hochaktiven Enzyme,
die Hydrolasen, Oxidasen und so weiter gibt, die weiter arbeiten. Sie setzen die Aktivierungsenergie herab und
lassen metastabile Zustände zusammenbrechen. Die hoch geordneten Strukturen der Lebewesen werden somit durch
Abbau der Makromoleküle unter Addition von Wassermolekülen zerstört. Dieser Prozess ist exotherm.
Da die Organismen wie auch der Mensch zu einem Großteil aus Wasser bestehen und sie letztlich strukturiertes Wasser sind, zerfließen sie regelrecht, da ihre stützenden Strukturen hydrolysiert werden. Die Entropie nimmt dabei zu, der Informationsgehalt ab. Das ist die chemische bzw. thermodynamische Grundlage der Verwesung. Die gesamte hochwertige Energie, die zuvor in den Molekülen des Systems "Lebewesen" steckte, wird innerhalb kürzester Zeit in nutzlose Wärme umgewandelt. Hinzu kommt die Bildung vieler kleiner Moleküle aus hoch geordneten Makromolekülen, die aus den chemischen Reaktionen als chaotische Gase (CO2, NH3 und H2O...) entlassen werden. Fremdorganismen wie Bakterien und Pilze unterstützen diesen exothermen Prozess. Sie wandeln einen Teil der anfallenden Reaktionsenergie in chemische Energie um - allerdings in der stofflichen Form ATP - und nutzen sie zum eigenen Vorteil. Hier gilt wieder die Gibbs-Helmholtzsche Gleichung. Die Grenzen werden deutlich, wenn man einen Komposthaufen betrachtet. Der ist warm - weil die Umwandlung von Reaktionswärme in Freie Enthalpie durch die Bakterien und Pilze nur sehr unvollkommen ist. Damit schließt sich der Kreis. Wir Menschen machen es übrigens nicht anders, wenn wir tierische oder pflanzliche Nahrung zu uns nehmen...
Ein toter Vogel zerfließt innerhalb weniger Tage
|
| 5) | Luft löst sich in kaltem Wasser besser, weil sich in exothermer Reaktion um
die hydrophoben Moleküle hoch geordnete Käfige aus Wassermolekülen legen (-> Webseite).
Beim Stehen in wärmerer Umgebung werden die Gasmoleküle wieder freigesetzt, weil dabei die Ordnung gestört wird
und die Entropie zunimmt.
Hier wird folgendes Prinzip deutlich: Bei exothermen Reaktionen ist in der Kälte der DH-Term besonders wirksam, in der Wärme dagegen der Entropie-Term T · DS. |
| 6) | Das Gleiche wie für hydrophobe Luftmoleküle gilt für in Wasser gelöste hydrophobe Substanzen wie Kohlenwasserstoffe, CKW oder Fette. Diese lösen sich in Grenzen in kaltem Wasser, indem sie (Entropie vernichtend) hoch geordnete Wassermolekülstrukturen um sich legen. Beim Stehen in warmer Umgebung bilden sich Fetttröpfchen oder Fettschichten. Wenn man Fett-Wassermischungen stark erhitzt, werden diese nicht offensichtlich gelöst? Das ist nur scheinbar, denn die Fetttropfen werden nur feinst zerteilt, aber nicht gelöst. Das ist Entropie steigernd. Beim Ankühlen bilden sich die Fettschichten zurück - und zum gewissen Teil bleiben echt gelöste Fette im Wasser. |
| 7) | Auch die Faltung von Poteinen ist thermodynamisch so zu erklären. Proteine falten sich bekanntlich so, dass die hydrophoben Aminosäurereste nach innen, die hydrophilen nach außen zeigen. Bemerkenswert ist die hohe Aktivierungsenergie, die für diesen Prozess notwendig ist - schließlich muss die Faltung geordnet verlaufen und nicht zufällig erfolgen. Die hohe Aktivierungsenergie dieses Vorgangs wird durch akzessorische Faltungsenzyme erniedrigt. |
Weitere Texte zum Thema „Energie und Chemie“