Prof. Blumes Bildungsserver für Chemie
Tipp des Monats März 2018 (Tipp-Nr. 249)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Brennbarer Schaum und Knallblasen!
Jens Schorn
Video 1: Brennender Schaum auf der Hand
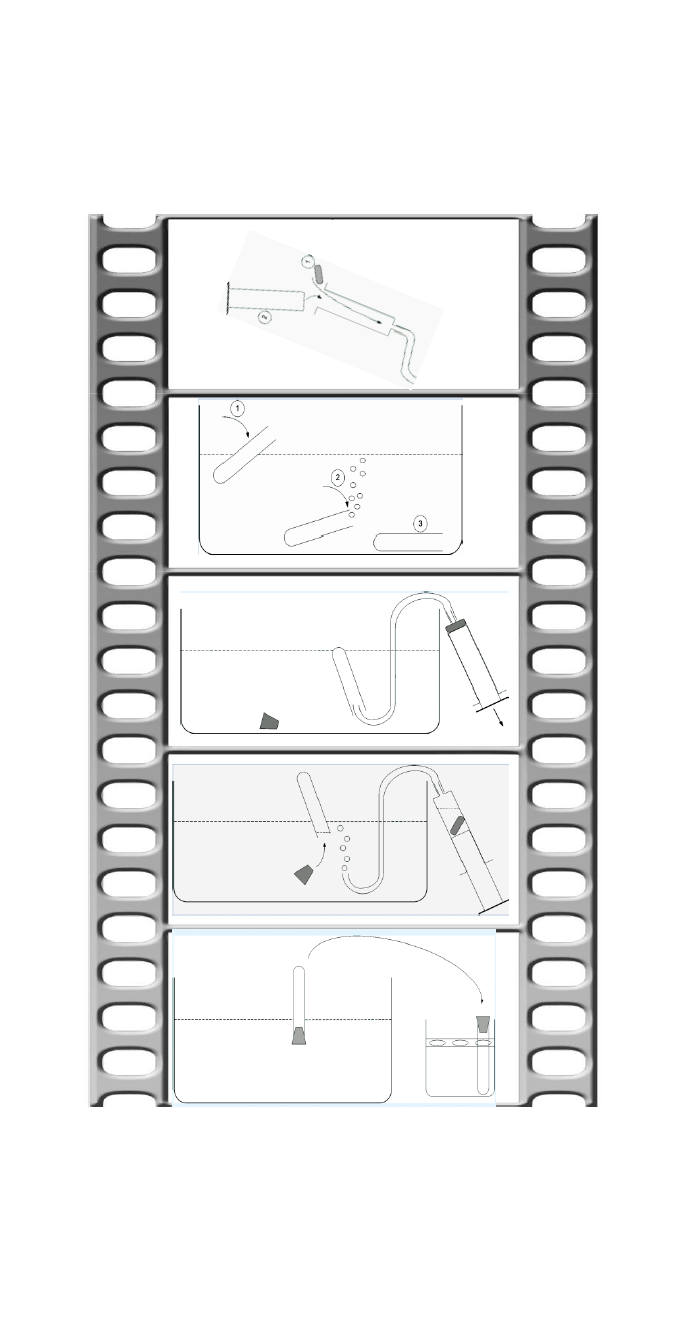
Diese Frage stellt sich in der Schule, wenn im Chemie Anfangsunterricht über die Entstehung von Bränden und Möglichkeiten der Brandbekämpfung gesprochen wird. Der bekannte Löschschaum, wie er bei der Verwendung von handelsüblichen Kohlenstoffdioxidlöschern entsteht, ist im Unterricht leicht durch pneumatisches Auffangen von Kohlenstoffdioxid aus Brausetabletten hergestellt. Versuch 1: Mit der Filmleiste und dem dazu passenden „Drehbuch“ als Anleitung kann das Gas aus der sich auflösenden Brausetablette leicht aufgefangen werden. Bild 1: Pneumatisches Auffangen von Kohlenstoffdioxid aus einer Sprudeltablette
Hat man mehrere Spritzen zur Verfügung, so kann man die Durchführung auch ohne Reagenzgläser durchführen. Der Vorteil liegt darin, dass man sofort die entstandene Gasmenge in den Spritzen ablesen kann. Bild 2: Pneumatisches Auffangen von Kohlenstoffdioxid mit Spritzentechnik
Kann flüssiger Schaum brennen oder sogar knallen?
(Film: Jens Schorn)
Illustration
Sprachliche Anweisung
(Bild: Schorn)

(Foto: Schorn)
Mit dem pneumatisch aufgefangenen Gas kann man dann in einer pneumatischen Wanne einen Schaum herstellen.
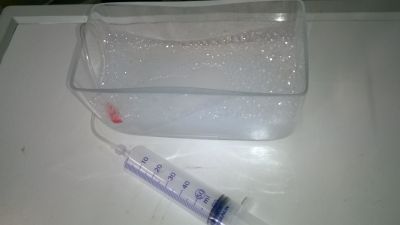
Bild 3: Schaumbildung in einer pneumatischen Wanne
(Foto: Schorn)
Die Eigenschaften des im Schaum eingeschlossenen Kohlenstoffdioxids bestimmen die Verwendung des Löschschaums zum Ersticken von Bränden.
Klick mich an!
Bild 4: Kohlenstoffdioxidschaum in einer pneumatischen Wanne aus der Vogelperspektive
(Foto: Schorn)
Hier kann man gut die Bildung der sogenannten Polyeder durch die Anlagerung der unterschiedlich großen Blasen erkennen. Entstehen gleichgroße Blasen im Schaum, so erkennt man eine hexagonale Regelmäßigkeit. Jede Schaumblase ist in einer Ebene von 6 gleichgroßen Blasen umgeben.
Mit weiteren im Labor vorrätigen Gasen können auf diese Weise auch andere Schäume mit anderen Eigenschaften hergestellt werden. Als Lösung verwendet man einfach herkömmliche Spülmittellösung oder einen tensidhaltigen Extrakt z.B. aus dem Seifenkraut.
Mit Methan, Butan und Wasserstoff ergeben sich folgende Schäume.
| Wasserstoffschaum | Methanschaum | Butanschaum |
|
|
|
|
Bild 5a-c: Wasserstoffschaum, Methanschaum, Butanschaum (Fotos: Jens Schorn) |
||
So kann man für Demonstrationszwecke in einem etwas größeren Maßstab unterschiedliche Schäume aus üblicherweise im chemischen Labor vorhandenen Gasen herstellen und miteinander vergleichen.
|
Versuch 2: Geräte und Chemikalien
Aufbau:
Bild 6: Schaumerzeugung für Demonstrationszwecke
Durch Öffnen der Gasquelle, kann man die Schaumbildung einfach kontrollieren. Video 2: Herstellung von Schaum für Demonstrationszwecke
|
Schon bei der Herstellung erkennt man deutliche Unterschiede. Während Methanschaum eher wie eine Säule nach oben steht, sinkt Butanschaum gleich nach dem Verlassen der Flasche zu Boden.

Bild 7: Methangasschaum und Butangasschaum im Vergleich
(Foto: Schorn)
Weshalb zeigen unterschiedliche Schäume unterschiedliche Eigenschaften?
Geht man davon aus, dass die Spülmittellösung immer die gleichen Eigenschaften bei den unterschiedlichen Schäumen aufweist, so werden die Schaumeigenschaften von dem Gas bestimmt, das sich in den Schaumblasen befindet.
Ein Blick ins Tafelwerk [1] zeigt die unterschiedlichen Dichten der verwendeten Gase.
Dichten bei Normbedingungen
Wasserstoff: 0,089 g/L
Sauerstoff: 1,429 g/L
Kohlenstoffdioxid: 1,977 g/L
Propan: 2,01 g/L
Butan: 2,703 g/L
Im Vergleich zur Raumluft, die bei Normalbedingungen eine Dichte von 1,293 g/L hat, wird schnell klar, dass Methangasschaum in Luft eher einen Auftrieb erfährt, während Butangasschaum mit einer doppelt so großen Dicht wie Luft, sofort nach unten fällt, wenn er die PET Flasche verlässt. Diese große Dichte eines Schaums ist auch der Vorteil bei der Verwendung von Kohlenstoffdioxidschaum, der bei dem Einsatz von sogenannten Kohlensäurefeuerlöschern entsteht. Das Gas bleibt am Boden und erstickt so das Feuer.
Mit den hergestellten Schäumen kann man nun weitere Eigenschaften wie z.B. die Brennbarkeit überprüfen.
Kann flüssiger Schaum brennen oder sogar knallen?
|
Versuch 3: Hergestellte Kohlenwasserstoffschäume (aus Methan oder Butan) kann man in geringen Mengen einfach in der Hand entzünden. Es ergeben sich effektvolle Bilder, die sich auch für Showexperimente eignen. Video 3: Verbrennung von Methangasschaum
Video 4: Verbrennung von Butangasschaum
Video 5: Verbrennung von Wasserstoffschaum
|
Achtet man auf die Geschwindigkeit mit der diese Schäume verbrennen, so stellt man fest, dass Butanschaum am langsamsten und Wasserstoffschaum am schnellsten verbrennt. Methangasschaum liegt dazwischen. Während die Schäume aus Methan und Butan eher verpuffen, explodiert der Wasserstoffschaum sogar mit einem deutlichen Knall. Diese Schäume sind also gut brennbar.
Warum brennen unterschiedliche Schäume unterschiedlich schnell?
Um dies zu erklären, betrachten wir die Verbrennungsreaktionen der Schäume genauer.
Sämtliche Reaktionen die hier ablaufen, sind Verbrennungsreaktionen, die nach folgenden Reaktionsgleichungen ablaufen:
| (1) | Wasserstoffschaum
2 H2 + O2 --> 2 H2O Volumenverhältnis: 2:1 |
ΔH=-242 kJ/mol |
| (2) | Methangasschaum
CH4 + 2 O2 --> CO2 + 2 H2O Volumenverhältnis: 1:2 |
ΔH=-889 kJ/mol |
| (3) | Ethangasschaum
2 C2H6 + 7 O2 --> 4 CO2 + 6 H2O Volumenverhältnis: 1:3,5 |
ΔH=-1557 kJ/mol |
| (4) | Propangasschaum
C3H8 + 5 O2 --> 3 CO2 + 4 H2O Volumenverhältnis: 1:5 |
ΔH=-2217 kJ/mol |
| (5) | Butangasschaum
2 C4H10 + 13 O2 --> 8 CO2 + 10 H2O Volumenverhältnis: 1:6,5 |
ΔH=-2874 kJ/mol |
Betrachtet man die Volumenverhältnisse zwischen dem verbrennenden Gas und Sauerstoff, erkennt man, dass Wasserstoff (1) für eine vollständige Reaktion am wenigsten Sauerstoff benötigt, während Methan (2) genau im umgekehrten Verhältnis mit Sauerstoff reagiert. Butangas (5) benötigt sogar die 6,5-fache Stoffmenge an Sauerstoff pro Stoffmenge Butan, um vollständig zu verbrennen.
Da Luft ein Stoffgemisch ist, in dem nur ca. 21% Sauerstoff enthalten ist, gelangt in der gleichen Zeit der ablaufenden Reaktion nicht genug Sauerstoff an das brennende Butangas. Bei der Verbrennung von Wasserstoff ist in der Luft genug Sauerstoff vorhanden, sodass die Verbrennung hier explosionsartig mit einem Knall abläuft.
Worin liegt der Unterschied zwischen einer Verpuffung und einer Explosion von Wasserstoff?
Findet eine Verbrennungsreaktion mit Volumenerweiterung aber mit nicht relevantem Druckaufbau statt, so spricht man von einer Verpuffung. Die Ausdehnungsgeschwindigkeit liegt hierbei zwischen 0,01-1 m/s. Früher galt als Vergleichsdruck in Abgrenzung zu einer Deflagration ein Verbrennungsdruck von 1 bar.
Ein bekanntes Beispiel ist die Verbrennung des Hindenburg-Zeppelins im Jahre 1937. Der Anteil an Wasserstoff war im Verhältnis zum vorhandenen Luftsauerstoff sehr groß, sodass eine Verpuffung, aber keine Explosion stattgefunden hat.
Liegt ein schneller Verbrennungsvorgang mit Explosionsdruck vor, der nur durch entstehende und sich ausdehnende Gase gebildet wird, so spricht man von einer Deflagration. Solche Vorgänge pflanzen sich durch die bei der Reaktion freiwerdende Energie fort. Das nicht verbrannte Gasgemisch zündet durch Aufheizung des verbrennenden Gemisches in der Flammenfront. Der Verbrennungsdruck ist kleiner als die Schallgeschwindigkeit und liegt in der Größenordnung von 10 bar. Solche Vorgänge sind druck- und temperaturabhängig.
Liegen höhere Ausbreitungsgeschwindigkeiten vor, so spricht man von einer Detonation. Bei Detonationen tritt die Ausbreitung der chemischen Reaktion im Sprengstoff gekoppelt mit einer Stoßwelle auf. Diese Stoßwelle ist größer als die Schallgeschwindigkeit vor der Stoßfront. Der Druck solcher Stoßwellen kann bis zu 500 kbar (500.000-facher Atmosphärendruck) erreichen.
Beispiele solcher Verbrennungsreaktionen können im Zusammenhang mit Kohlenwasserstoffen, sogenannten Alkane, z.B. im Verbrennungsmotor zu Detonationen führen, wenn Frühzündungen auftreten. Temperatur und Druck steigen bei der Verdichtung des Gasgemisches im Zylinder schlagartig an, sodass eine Detonationswelle entstehen kann [2].
Wie kommt man vom brennenden Schaum zum knallenden Schaum?
Um dies zu erreichen, sollte man unbedingt die Empfehlungen der Kultusministerkonferenz „Richtlinien zur Sicherheit im Unterricht“ [3] zu Knallgasexplosionen beachten.
„Knallgas- oder Chlorknallgasexplosionen nur mit kleinen Mengen durchführen (Seifenlösung, 10 ml Einwegspritze, Reagenzglas). „Papprohrversuch" mit Kohlenwasserstoffen und Luft, nicht jedoch mit Sauerstoff durchführen.“
Das bedeutet für die folgenden Experimente, nur mit geringen Mengen des Schaums zu arbeiten. Zu empfehlen sind maximal 10 Blasen für optimale Knallgasgemische aus Brennstoff und Sauerstoff.
Für die Arbeit mit geringen Stoffmengen bieten sich Geräte aus dem medizintechnischen Zubehör, wie sie von unterschiedlichen Anbietern bekannt sind, an [4].
|
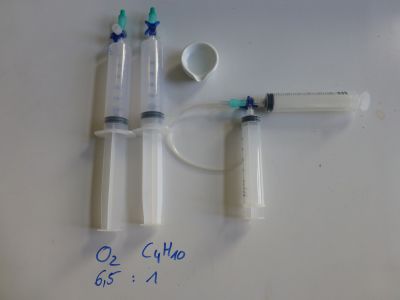
Versuch 4: Herstellung von Knallgasschäumen mit Wasserstoff, Methan und Butangas Materialien: Gehörschutz!!! Gasquellen: Zwei 60ml Spritzen mit Luer-Loc Anschlüssen, jeweils gefüllt mit Sauerstoff bzw. dem brennbaren Gas (Wasserstoff, Methan oder Butan); Mischraum: Zwei 30ml Spritzen mit Luer-Loc Anschlüssen, die über einen Drei-Wege-Hahn verbunden sind;
Durchführung: Man schließt die Gasquellen über den Drei-Wege-Hahn an die Mischraumspritzen an und befüllt für die unterschiedlichen Knallgasgemische mit den passenden Volumenanteilen.
Klick mich an! Bild 8: Ausstattung für Knallgasschaumherstellung
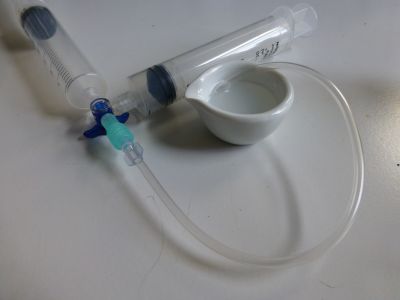
Klick mich an! Bild 9: Knallgasgemisch im Mischraum
Man achte darauf, dass insgesamt nicht mehr als 30ml Gasgemisch entsteht. So kann man die beiden Gas durch Hin- und Herdrücken der verbundenen Spritzenkolben gut miteinander vermischen. Dann schließt man den Schlauch an und drückt das Gasgemisch in die Spülmittellösung, sodass ein Schaum entsteht. Bevor man die Zündung vornimmt, sollte man einen Gehörschutz einsetzen. Video 6: Herstellung und Zündung eines Knallschaums aus Butangas und Sauerstoff
|
Alle drei Knallgasgemische verbrennen explosionsartig mit einer deutlich spürbaren Druckwelle, sodass hier also Deflagrationen vorliegen.
Diese Druckwelle kann man auch mit Hilfe einer auf dem Smartphone installierten App zur Messung der Lautstärke messen.
Video 7: Messung der Lautstärke einer Knallgasexplosion
(Film: Jens Schorn)
Bei vergleichbaren Messungen mit anderen Knallgasen kommt man auf folgende Ergebnisse:
| Knallgasgemisch | Lautstärke in dBA |
| Wasserstoff-Sauerstoff | 71,2 |
| Methan – Sauerstoff | 74 |
| Butangas-Sauerstoff | 73,9 |
Detonationen entstehen hier zwar nicht, da sich Druck und Temperatur fast ungehindert ausbreiten können, aber die Explosionen sind stark genug, um das Ohr zu schädigen.
Die gemessenen Lautstärken liegen unterhalb des Pegels von 85 dB, ab der man bei langfristiger Einwirkung Gehörschäden erleiden kann, aber der kurzfristig auftretende Explosionsdruck, der als Schalldruck auf das Trommelfell trifft, kann hoch genug sein, um das Trommelfell zu zerreißen. Es entsteht dann eine sogenannte Ruptur und das Trommelfell kann dann durch den Schallwechseldruck bei normalem Hören nicht mehr in Schwingungen versetzt werden und ist geschädigt.
Deshalb stets Schallschutz bei solchen Explosionen tragen.
Fazit:
Brennbare Schäume sind leicht und sicher herstellbar und eignen sich auch gut für Showexperimente. Man kann gut die unterschiedlichen Dichten und Brennbarkeiten demonstrieren.
Die Knallgasschäume sind in geringen Mengen ebenfalls gut verwendbar, da es keine eingeschlossenen bzw. verdämmten Gasgemische gibt. Die Schäume sind stabil genug, um sie zur Entzündung zu bringen und damit die Eigenschaften der Gase und Gasgemische zu zeigen. Die geringe Stabilität der Schäume ist hier ein Vorteil, da durch Zerfall des Schaums und die Verdünnung der Gasgemische mit der Umgebungsluft das Explosionsrisiko schnell abnimmt und damit das Gasgemisch keine Gefährdung mehr darstellen kann.
Damit ist die Verwendung von Flüssigkeitsschäumen als Reaktionsraum sicherlich gefahrloser als alternative Experimentieransätze, bei denen die Gasgemische in Spritzenkörpern gezündet werden.
Quellen:
[1] Das große Tafelwerk Cornelsen Volk und Wissen, 1. Auflage 2011, Berlin.
[2] Köhler, J.; Meyer, R.; Explosivstoffe; 7.Auflage VCH Verlag; Weinheim 1991.
[3] RICHTLINIE ZUR SICHERHEIT IM UNTERRICHT (RiSU) Empfehlung der Kultusministerkonferenz. Beschluss der KMK vom 09.09.1994 i. d. F. vom 26. Februar 2016. S. 81
[4] http://chemz.webshopapp.com/
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. Februar 2018, Fritz Meiners