Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juli 2018 (Tipp-Nr. 253)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Sabine Streller
Viele Menschen, die unter häufigen Wadenkrämpfen leiden, greifen zu Magnesiumpräparaten, um ihr Leiden zu mindern. Solche Präparate werden als Tabletten, als Pulver zum Einnehmen, als Brausetabletten oder Trinkgranulat von verschiedenen Herstellern angeboten. Die meisten der Brausetabletten und Trinkgranulate enthalten neben dem Wirkstoff Magnesiumcarbonat oder Magnesiumcitrat auch Farbstoffe. Sieht ja auch appetitlicher aus! Doch wenn man das Getränk nicht sofort zu sich nimmt, passiert in recht kurzer Zeit das Folgende: Die Lösung wird fast farblos. Bild 1: Brausepulvergetränk auf der Terrasse im Laufe einer Stunde
Versuch 1: Einfluss von Licht Material: Becherglas (250 mL), 2 Erlenmeyerkolben (100 mL) mit Stopfen, eine Magnesium-Brausetablette oder Magnesium-Trinkgranulat mit Riboflavin als Farbstoff, Wasser Das Becherglas wird mit etwa 220 mL Wasser gefüllt und die Brausetablette oder das Granulat darin gelöst. Das Getränk wird dann so auf beide Erlenmeyerkolben verteilt, dass beim Aufsetzen des Stopfens keine Luft im Kolben enthalten ist. Ein Erlenmeyerkolben wird in das Sonnenlicht gestellt, aber so, dass es sich nicht erwärmen kann. Der andere Kolben wird an einen dunklen Ort gleicher Temperatur gestellt. Nach einer Stunde werden die Kolben miteinander verglichen. Versuch 2: Einfluss von Wärme Material: Becherglas (250 mL), 2 Erlenmeyerkolben (100 mL) mit Stopfen, eine Magnesium-Brausetablette oder Magnesium-Trinkgranulat mit Riboflavin als Farbstoff, Wasser Das Becherglas wird mit etwa 220 mL Wasser gefüllt und die Brausetablette oder das Granulat darin gelöst. Das Getränk wird dann so auf beide Erlenmeyerkolben verteilt, dass beim Aufsetzen des Stopfens keine Luft im Kolben enthalten ist. Ein Erlenmeyerkolben wird in eine Schüssel mit Eiswasser gestellt, der andere Kolben wird in ein Wasserbad von 40 °C gestellt. Beide Kolben müssen im Dunkeln platziert werden (dazu kann man die Kolben auch mit Alufolie umwickeln. Nach einer Stunde werden die Kolben miteinander verglichen. Versuch 3: Einfluss von Sauerstoff Material: Becherglas (250 mL), eine Kristallisierschale, ein Erlenmeyerkolben (100 mL) mit Stopfen, eine Magnesium-Brausetablette oder Magnesium-Trinkgranulat mit Riboflavin als Farbstoff, Wasser Das Becherglas wird mit etwa 220 mL Wasser gefüllt und die Brausetablette oder das Granulat darin gelöst. Ein Erlenmeyerkolben wird so mit dem Getränk gefüllt, dass beim Aufsetzen des Stopfens keine Luft im Kolben enthalten ist. Die gleiche Menge Getränk wird in eine Kristallisierschale gegeben, damit die Kontaktfläche zur Luft und damit zu Sauerstoff hoch ist. Der Kolben und die Schale werden an einen dunklen Ort gleicher Temperatur gestellt. Nach einer Stunde werden die beiden Proben miteinander verglichen.

(Foto: Streller)
Was ist die Ursache der Entfärbung?
Die Verpackung verrät, um welchen Farbstoff es sich handelt: Riboflavin. Schauen wir uns zunächst an, welchen Bedingungen das Getränk - und damit der Farbstoff - ausgesetzt ist. Die Sonne scheint, es ist ein warmer Sommertag und das Glas ist abgedeckt. Unsere Vermutung: Entweder beeinflussen das Licht, die Wärme oder der Sauerstoff die Zersetzung des Farbstoffes. Damit wir die drei Variablen unabhängig voneinander untersuchen können, müssen die beiden übrigen Größen konstant gehalten und nur eine Variable verändert werden.
Das Ergebnis ist eindeutig: Ein Farbunterschied zwischen beiden Getränkeportionen tritt nur unter dem Einfluss von Licht auf.
Was ist Riboflavin?
Riboflavin wurde erstmals als gelbe Substanz 1920 aus Milch gewonnen. Früher trug es daher den Namen Lactoflavin, um den Bezug zu seiner Herkunft zu betonen (lat. lac, Milch; flavus, gelb). Heute zählt es zur Gruppe der B-Vitamine und ist bekannt als Vitamin B2. Da es auch in der Lebensmittelindustrie als Lebensmittelfarbstoff eingesetzt wird, besitzt es natürlich auch eine E-Nummer: E 101.
Riboflavin zählt zu den wasserlöslichen Vitaminen, obwohl es nur wenig in Wasser löslich ist. Riboflavin ist Bestandteil von Flavinnucleotiden wie FAD (Flavin-Adenin-Dinucleotid). Flavinnucleotide sind gelb, je nach Bindung an das Protein können sie manchmal aber auch rot oder braun sein [1]. Sie nehmen eine zentrale Rolle im Stoffwechsel von Organismen ein, da sie Bestandteil der Oxidoreduktasen sind. Diese große Gruppe von Enzymen katalysiert Redoxreaktionen im Körper, ist also an der Wasserstoff- und Elektronenübertragung im Stoffwechsel beteiligt.
FAD ist zum Beispiel an den Redoxreaktionen der Glykolyse und am Citronensäurezyklus sowie an der Atmungskette beteiligt und somit für die Energiebereitstellung in Organismen bedeutsam.
Schauen wir uns den Bau des Farbstoffmoleküls an: Die Struktur von Riboflavin zeigt, dass es aus einer chromophoren Gruppe (Isoalloxazin-Ring) und einem Zuckeralkoholrest (abgeleitet von der Ribose; daher der Name Riboflavin) besteht:
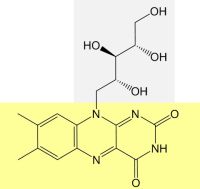
Bild 2: Struktur von Riboflavin (gelb: chromophore Gruppe Flavin, grau: Ribityl-Rest)
Die chromophore Gruppe ist einerseits für die Farbigkeit des Farbstoffes, andererseits aber auch für seine fluoreszierende Eigenschaft verantwortlich. Die reduzierten Riboflavinnukleotide erscheinen farblos, absorbieren aber UV-Licht [1]. Alle ablaufenden Reaktionen, an denen riboflavin-haltige Coenzyme beteiligt sind, sind überaus komplex, und nicht alle Zwischenstufen sind vollständig geklärt.
Insbesondere die leuchtend gelbe Farbe macht Riboflavin als Lebensmittelfarbstoff attraktiv. Aber auch die fluoreszierende Wirkung macht man sich zu Nutze - so lässt sich der Farbstoff als Kontrollsubstanz bei Reinigungsprozessen in der pharmazeutischen Industrie einsetzen. Reinigungsmitteln wird Riboflavin zugesetzt und mittels einer UV-Lampe kann dann kontrolliert werden, ob wirklich das gesamte Reinigungsmittel aus der Anlage herausgespült worden ist.
Warum verschwindet die gelbe Farbe im Licht?
Festes Riboflavin ist lichtstabil. Wässrige Riboflavin-Lösungen jedoch verlieren nach kurzer Zeit ihre gelbe Farbe, fluoreszieren aber noch im UV-Licht. Man weiß inzwischen, dass Redoxprozesse und der pH-Wert eine Rolle spielen, jedoch sind die ablaufenden Reaktionen nicht gänzlich geklärt. Verschiedene Abbauprodukte konnten bereits nachgewiesen werden. Für den interessierten Leser verweisen wir auf [2; 3].

Bild 3: Getränk mit Magnesium-Trinkgranulat im UV-Licht, links frisch hergestelltes Getränk, leuchtend gelb im Sonnenlicht, rechts eine Stunde altes Getränk, fast farblos im Sonnenlicht
(Foto: Streller)
Ein Nachweis für Riboflavin in Lebensmitteln
Riboflavin hat als Lebensmittelfarbstoff E 101 ein breites Anwendungsspektrum. So finden wir es in Vanillepuddingpulver, Mayonnaise, Fertiggerichten, Getränken und Multivitamin-Brausetabletten oder eben Magnesium-Trinkgranulaten. Natürlich lässt es sich der Zusatz von Riboflavin leicht in Lösung mit UV-Licht nachweisen. Aber es gibt auch eine – leider manchmal etwas kniffelige – Nachweisreaktion mit Silbernitrat. Kniffelig ist die Reaktion deshalb, weil man das störende Citrat zunächst mit Calcium-Ionen binden muss. Der Nachweis gelingt leicht und unkompliziert – und auch ohne Kalkwasser-Zusatz – im Vanillepuddingpulver.
|
Versuch 4: Nachweis von Riboflavin in Magnesium-Trinkgranulat Material: Becherglas (100 mL), 2 Reagenzgläser, Reagenzglasständer, Pipette, Spatel, 1 Tütchen Magnesium-Trinkgranulat (z.B. von Diasporal®), Wasser, Silbernitrat, Kalkwasser (gesättigte Calciumhydroxid-Lösung) Ein halbes Tütchen Magnesium-Trinkgranulatpulver wird in 50 mL Wasser gelöst. Die Lösung wird in die Reagenzgläser gefüllt, so dass sie ca. halbhoch gefüllt sind. Ein Reagenzglas dient als Vergleichsprobe. In das andere werden zunächst 1 mL Kalkwasser und anschließend ca. 0,1 g Silbernitrat (eine kleine Spatelspitze) gegeben. Sollte noch kein Farbumschlag auftreten, werden erneut vorsichtig einige Tropfen Kalkwasser hinzugegeben, bis der Farbumschlag einsetzt.
Bild 4: Nachweis von Riboflavin in Magnesium-Trinkgranulat
|
Danksagung: Mein Dank geht an Maurice Gerdawischke für seine tatkräftige Unterstützung.
Literatur:
[1] K. Dose (1994). Biochemie. Eine Einführung. Berlin, Heidelberg: Springer, 4. Aufl.
[2] I. Ahmad et al. (2004). Photolysis of riboflavin in aqueous solution: a kinetic study. Int. Journ. Pharm. 280, 199–208
[3] Muhammad Ali Sheraz et al. (2014). Photo, thermal and chemical degradation of riboflavin. Beilstein J. Org. Chem. 10, 1999–2012. doi:10.3762/bjoc.10.208
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 8. Juni 2018, Fritz Meiners
