Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Oktober 2018 (Tipp-Nr. 256)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Was die Van der Waals-Gleichung mit der Dampfkurve verbindet
Rüdiger Blume
Für viele Schüler bedeutet sie puren Schrecken, die Van der Waals-Gleichung: (p + a / V2) (V - b) = R · T (Im Folgenden kürzen wir van der Waals mit VdW ab.) Wir haben mit dieser Gleichung mehr zu tun als wir meinen: Bei unserem Kühlschrank profitieren wir vom Energieaustausch bei der Kompression von Gasen. Gleiches gilt für die Wärmepumpe im Heizungskeller. Im Gasfeuerzeug tragen wir verflüssigtes Gas (im Allgemeinen Butan) mit uns herum, das wir anzapfen, wenn wir das Feuerzeug entzünden. Wenn das Gasfeuerzeug aus transparentem Kunststoff gefertigt ist, kann man das verflüssigte Gas sogar sehen. Bild 1: Gasfeuerzeug mit Flüssiggas
Aber auch in vielen Spraydosen sind verflüssigte Gase enthalten. Die kann man hören, wenn man die Spraydose schüttelt. Weiter: Unser Wetter und die Wolken beruhen auf der Verflüssigung von Wasserdampf. Für ein Mol Gas lautet die Gleichung: (1) (p + a / V2) (V - b) = R · T Der Term a / V2 ist der Binnendruck. Der Term b heißt Eigenvolumen. Um zu verstehen, was diese Terme bedeuten, vergleichen wir die VdW-Gleichung mit der Gleichung für Ideale Gase. Letztere ist bekanntlich: (2) p · V = R · T 1. Das Modell des Idealen Gases beruht auf Teilchen, die kein Volumen haben. Sie stoßen einander, tauschen dabei aber die Impulse verlustlos aus (sogenannte Ideale Stöße). Dieses Modell ist gültig, wenn die Temperaturen sehr hoch sind, das Volumen groß ist und die Teilchen sich rasch bewegen.
2. In der Theorie zum Realen Gas wird das Eigenvolumen der Teilchen nicht mehr vernachlässigt. Damit hat das Gas für seine Bewegung einen kleineren Raum. Man zieht deshalb dieses Eigenvolumen b vom Volumen V des mit Gas gefüllten Gefäßes ab: (3a) p · V = R · T (V-b) ist also das Volumen, welches dem Gas zur Verfügung steht. Die Größe der Teilchen beschreibt man übrigens mit Hilfe des sogenannten Van der Waals-Radius. Des Weiteren kann man in der Nähe des Siedepunkts bzw. Kondensationspunkts auch die Anziehungskräfte zwischen den Teilchen nicht mehr vernachlässigen, denn diese ermöglicht ja erst die Flüssigkeitsbildung bei der Kondensation. Die Anziehungskräfte wirken sich so aus, als würden sie den von außen ausgeübten Druck verstärken. Der Term enthält deshalb einen positiven Korrektur-Term, den Binnendruck a/V2: (3b) p -> p + a / V2 Die Konstanten a und b werden experimentell bestimmt. Beispiele: Bei hohen Temperaturen und großen Volumen geht die VdW-Gleichung in die Gleichung idealer Gase über. Eine „Kritische Isotherme“ Tkrit trennt den Bereich der Gültigkeit der beiden Gasgesetze von einander. Die zugehörigen p- und V-Werte heißen Kritischer Druck und Kritisches Volumen. Exemplarische Kritische Daten Oberhalb von Tkrit kann kein Gas verflüssigt werden. Wir verstehen nun, warum man früher bei einigen Gasen wie Wasserstoff oder Stickstoff von Permanenten Gasen sprach: Man konnte sie nicht verflüssigen, weil schlicht die Technologie zur Bereitstellung tiefer Temperaturen und entsprechender Drücke fehlte. Wir können jetzt auch erklären, warum die Spraydose beim Entleeren kalt wird: Zum Trennen der Moleküle beim Expandieren ist Energie in der Form von Wärme nötig. Diese entzieht das Gas seiner Umgebung, hier der Spraydose. Das Verständnis der Eigenschaften Realer Gase hat erst die Gasverflüssigung ermöglicht. Gasverflüssigung – ist das nicht eine schwierige Technik? Nein, sie läuft sogar vor unseren Augen ab, zum Beispiel beim Verdunsten von Wasser. Die Bezeichnung Wasserdampf ist eigentlich unglücklich gewählt; denn es handelt sich dabei nicht um Dampf im physikalischen Sinne, sondern um ein farbloses Gas, das beim Verdunsten entweicht. Das was wir sehen, ist nicht das Gas, sondern dampfförmiges Wasser, das aus kleinen Tröpfchen besteht. In der Technik spricht man von Nassdampf.

(Foto: Blume)
Die VdW-Gleichung beschreibt das Verhalten von Realen Gasen
Darunter versteht man Gase in der Nähe ihres Siedepunkts.
Vergleich von idealen und realen Gasen
Die Kritik ist: Wenn man auf T = 0 K extrapoliert, folgt V = 0. Das kann nicht sein, denn wir wissen, das Gase aus realen Atomen und Molekülen bestehen und deshalb ein Eigenvolumen besitzen müssen!
Außerdem sollten die Gasteilchen untereinander keine Anziehungskräfte ausüben. Dann konnte man nicht erklären, warum es zur Abkühlung kommt, wenn man ein komprimiertes Gas entspannt. Das erkennt man z. B., wenn man eine Spraydose entleert: Sie kühlt dabei zunehmend ab. Andererseits werden Gase beim Komprimieren heiß; Stichwort Fahrradpumpe.
Gas
H2
CO2
H2O
a (L2 · bar · mol-2)
0,248
3,64
5,54
b (L · mol-1)
0,0266
0,0427
0,0305
Gas
H2
N2
O2
CO2
n-Butan
H2O
Tkrit (°C)
-240
-147
-119
31
152
374
Pkrit (bar)
13
34
50,4
73,8
38
220
Die VdW-Kurve ist eine Parabel dritten Grades
Durch Umstellen lässt sich die folgende Funktion aus der VdW-Gleichung herleiten:
(4) p · V3 – (b · p + R · T) V2 + a (V – b) = 0
Diese Kurve zeigt einen Wendepunkt sowie ein Maximum und Minimum; sie entspricht in ihrem Verlauf mit dem liegendes S einer Parabel dritten Grades. (Das kann man ja mal im Mathe-Unterricht durchspielen!) Bei der VdW-Gleichung handelt es sich allerdings nur um ein mathematisches Modell, das nicht in allen Bereichen der messbaren Realität entspricht.
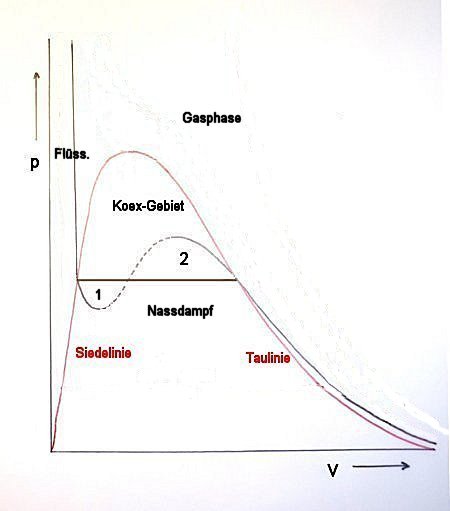
Bild 2: Isotherme der VdW-Kurve als Parabel 3. Grades
Gibt es den Parabelverlauf mindestens zum Teil?
Allerdings kann man den mathematischen realen Kurvenverlauf zumindest in Grenzen zeigen. Das ist dann der Fall, wenn Hemmungen bei den Phasenübergängen auftreten. Es handelt sich hier um metastabile Zustände. So kann eine Flüssigkeit überhitzt werden (Minimum-Bereich 1 in Bild 2). Oder eine Gasphase kann unterkühlt werden (Maximum-Bereich 2 in Bild 2).
- Minimum: Im Labor fürchtet man zu Recht den Siedeverzug von Flüssigkeiten.
- Maximum: Am Himmel sieht man Kondensstreifen von hochfliegenden Flugzeugen, die auf den dort vorliegenden unterkühlten Wasserdampf schließen lassen. Hier handelt es sich um einen Kondensationsverzug.
Die Hemmung nutzt man technisch vor allem in der Kernphysik zum Nachweis von radioaktiver Strahlung oder von Partikelschauern, die bei Kernreaktionen auftreten. Hier sind zwei klassische und auch heute noch genutzte Nachweisverfahren zu nennen:
Siedeverzug: In der Blasenkammer befindet sich flüssiger Wasserstoff nahe am Siedepunkt. Die Siede-Hemmung wird durch Dampfbildungskeime überwunden. Tritt Strahlung ein, so beobachtet man entlang deren Laufstrecke die Bildung von Gasbläschen.
Kondensationsverzug: In der Wilsonschen Nebelkammer befindet sich eine unterkühlte Gasphase. Diese stellt man her, indem man einen Tropfen Ether in eine kleine Kammer gibt und diese schockartig entspannt. Treten nun radioaktive Strahlen ein, so sieht man Nebelspuren. Die Wilsonsche Nebelkammer sollte sich in vielen Schulen im Physikraum befinden.
Wie sieht die VdW-Kurve in der Praxis aus?
Statt des Wendepunktbereichs, der dem liegendem Buchstaben S ähnelt, erhält man in der Praxis nur einen waagerechten Strich mit p, T = konst. Das kommt daher, dass ein Gas, das isotherm komprimiert wird, ab einem bestimmten Volumen zu kondensieren beginnt. Dadurch bleibt der Druck konstant – allerdings nur solange, bis das gesamte Gas verflüssigt ist. (Man spricht vom Taupunkt. Beim umgekehrten Verlauf heißt er Siedepunkt.) Anschließend steigt der Druck bei nur noch geringer Volumenänderung stark an – weil Flüssigkeiten kaum komprimierbar sind.
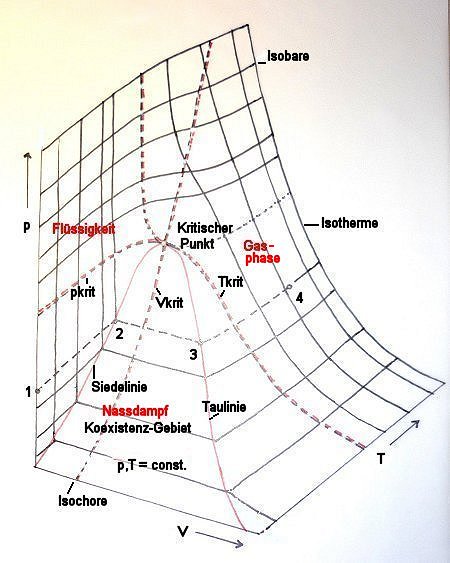
Bild 3: Dreidimensionale Darstellung der van der Waals-Kurve
Die schematische Darstellung der Gesetze idealer und realer Gase erfordert eigentlich nur drei Kurven im p-V-Diagramm:
- Eine VdW-Kurve mit T >> Tkrit (entspricht dem idealen Gasgesetz p · V = R · T)
- Eine VdW-Kurve mit T = Tkrit
- Eine VdW-Kurve mit T << Tkrit
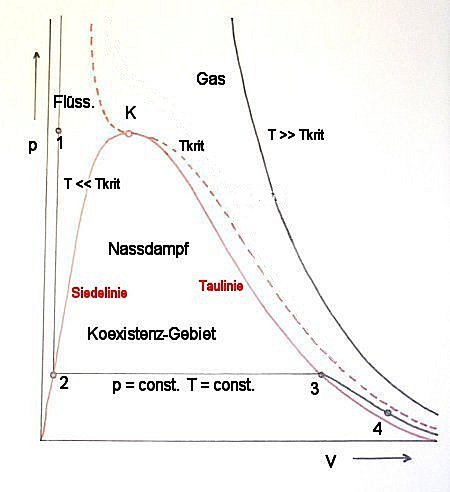
Bild 4: Schematische Darstellung der drei wichtigsten Kurven der Gasgesetze
Wie sieht das Koexistenz-Gebiet im p,T-Diagramm aus?
Da für variables Volumen p und T konstant bleiben, muss es für jedes p-T-Paar einen Punkt ergeben, indem sich die Volumentemperaturkurven (Isochoren) für den Dampf- und für den Flüssigbereich schneiden. Alle diese Punkte bilden die Dampfdruckkurve. Der Beginn der Kurve ist der Tripelpunkt, das Ende ist der Kritische Punkt. Im Tripelpunkt befinden sich die feste, flüssige und gasförmige Phasen im Gleichgewicht. Oberhalb des Kritischen Punkt liegt der Bereich des überkritischen Gases.
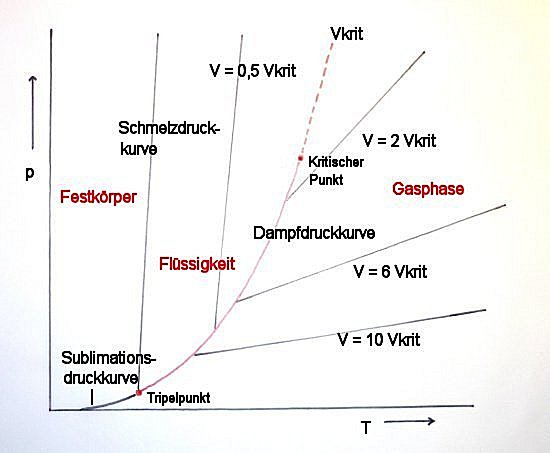
Bild 5: Dampfdruckkurve mit Isochoren (Kurven mit konstantem Volumen)
Aus der Steigung der Dampfdruckkurve lässt sich übrigens die Verdampfungswärme berechnen.
Wie sieht überkritisches Gas aus?
Das sieht aus wie eine normale Flüssigkeit – allerdings zeigen die Teilchen kaum eine Wechselwirkung. Sie werden nur aufgrund des hohen Außendrucks zusammengehalten. Sie haben deshalb ganz andere Eigenschaften als vergleichbare Flüssigkeiten. Beispielsweise wird mit überkritischem CO2 Kaffee entcoffeiniert – indem man das Koffein mit der Flüssigkeit extrahiert.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. September 2018, Fritz Meiners