Prof. Blumes Bildungsserver für Chemie
Tipp des Monats April 2019 (Tipp-Nr. 262)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Die magische „Sandformel“ – ein wenig entzaubert
Uwe Lüttgens
Haben Sie in Ihrer Kindheit schon mal mit Sand und Wasser im Wohnzimmer gespielt? Sicherlich nicht! Falls doch, hoffe ich sehr, dass Ihre Eltern nichts gemerkt haben. Denn sonst hätte es bestimmt ein Donnerwetter gegeben ob der angerichteten Mantscherei in der guten Stube. Mit dem sogenannten „magischen Sand“ soll man dagegen auch im Wohnzimmer kreativ mit Sand spielen können. Ein Anbieter dieses besonderen Spielsandes wirbt jedenfalls: „Graben, Formen und Sandburgen bauen sind nun auch bei schlechtem Wetter kein Problem mehr, denn unser Indoor-Knetsand kombiniert die vorteilhaften Beschaffenheiten von Knete mit den besonderen Eigenschaften des Sands und besitzt somit eine optimale Formbarkeit, …“ [1] Bild 1: Ein Triceratops ("Dreihorn-Gesicht") im Sand, einmal mit „normalem“ Quarzsand und einmal mit „magischem“ Sand geformt
Nimmt man den magischen Sand zwischen die Hände, spürt man gleich, was daran so magisch ist: Er rieselt nicht wie „normaler“ Sand, stattdessen fließt er einfach durch die Finger. Sofort wird uns klar, warum der Sand häufig auch als „Kinetic Sand“ bezeichnet wird. Ins Deutsche übersetzt bedeutet dies wohl so viel wie „beweglicher“ oder „bewegter“ Sand.
Versuch: Sand und magischer Sand – hydrophil oder hydrophob? Materialien/Chemikalien:
Durchführung:
Beobachtung:
Hinweis:
Bild 2: Verhalten von Quarzsand (A, links) und „Kinetic Sand“ (B, rechts) mit Wasser (oben) und Ethanol (angefärbt, unten)

(Foto: Lüttgens)
Ein einfaches Experimente mit kinetischem Sand
2 einfach geteilte Petrischalen, Einmalpipetten, Löffelspatel, 2 kleine Bechergläser (50 ml), jeweils mit Quarzsand (Spielsand) (Probe A) bzw. „Kinetic Sand“ (Probe B) befüllt, 2 kleine Erlenmeyerkolben (50 ml) mit Leitungswasser bzw. Ethanol.
Zur Vorbereitung werden der Quarzsand (A) und „Kinetic Sand“ (B) jeweils in einer Petrischale auf die beiden Fächer aufgeteilt. Tropfenweise wird nun zu jeder Probe jeweils Wasser in das eine Fach und. Ethanol in das andere Fach pipettiert und anschießend miteinander verglichen.
Der Quarzsand (A) wird vom Wasser vollständig benetzt und zunehmend durchfeuchtet, er verhält sich bei Zugabe von Wasser also hydrophil. Die Zugabe von Ethanol führt zu keiner Durchfeuchtung des Sandes.
Anders beim „Kinetic Sand“ (B): Das Wasser perlt ab, dieser Sand verhält sich bei Zugabe von Wasser also hydrophob. Bei zunehmender Wassermenge klumpt der hydrophobe Sand zusammen. Demgegenüber führt die Zugabe von Ethanol zu einer Durchfeuchtung des magischen Sandes.
Sollen die Versuche als Lehrerdemonstration durchgeführt werden, bieten sich hohe, schmale Bechergläser an, die bereits mit Wasser bzw. Ethanol befüllt sind, bevor sie mit den jeweiligen Sandproben befüllt werden. Ethanol kann angefärbt werden, um die beiden Flüssigkeiten besser unterscheiden zu können. Vor dem Versuch bietet es sich an, mit dem „Kinetic Sand“ ein wenig zu spielen, ihn durch die Finger rinnen zu lassen oder zu formen.
(Foto: Lüttgens)
Kinetic Sand – mit magischer „Sandformel“?
In den Hinweisen des oben bereits zitierten Herstellers heißt es: Der magische Sand „lässt sich durch seine oberflächenfreundliche Handhabung wieder rückstandslos entfernen. Durch die von uns eigens entwickelte Sandformel [beide Hervorhebungen durch den Autor] können die Sandkunstwerke über Wochen stehengelassen werden, ohne dabei auszutrocknen, und sind nach kurzem Kneten wieder genauso soft wie am ersten Tag!“ [1]. Gehen wir der „Sandformel“ mal genauer auf den Grund!
Für Quarzsand gibt es eine Verhältnisformel
Auch wenn mit Sand nicht immer reiner Quarz gemeint ist, so besteht der überwiegende Teil aller Sande aus dieser kristallinen Form des Siliciumdioxids – in Formelschreibweise kurz SiO2. Was sagt uns diese Formel? Besteht Quarzsand aus einzelnen Molekülen? Die Eigenschaften von Sand sprechen eindeutig dagegen: Sand ist hart, sehr hart. Daher auch sein Name: Der Begriff Quarz leitet sich ab von kwardy, was im Westslavischen so viel wie hart heißt. Mit einer MOHS-Härte von 7 ist Quarz härter als z. B. Zahnschmelz mit der Härte 5, allerdings längst nicht so hart wie z. B. Korund oder Diamant.
Dies spricht eindeutig gegen einen Stoff, der aus einzelnen Molekülen aufgebaut ist. Die Wechselwirkungen zwischen den Molekülen wären auch kaum stark genug, diese in einem Sandkorn bis zu Temperaturen von über 1700 °C zusammenzuhalten – denn dann erst fängt Quarzsand an zu schmelzen.
Tatsächlich handelt es sich bei Siliciumdioxid um ein dreidimensionales Netzwerk, in dem viele einzelne Siliciumatome über Sauerstoffatome miteinander verbunden sind. Quarz besteht also aus einem Atomgitter, in dem die Sauerstoffatome Brücken bilden zwischen Siliciumatomen Brücken bilden. Betrachtet man ein einzelnes Siliciumatom, so ist dieses tetraedrisch von vier Sauerstoffatomen umgeben. Umgekehrt sind alle O-Atome von zwei Si-Atomen umgeben. Die einzelnen SiO4-Tetraeder knüpfen über ihre Ecken ein räumliches Netz aus, das dem eines Diamant-Kristallgitters sehr ähnelt. Daher rührt seine große Härte.
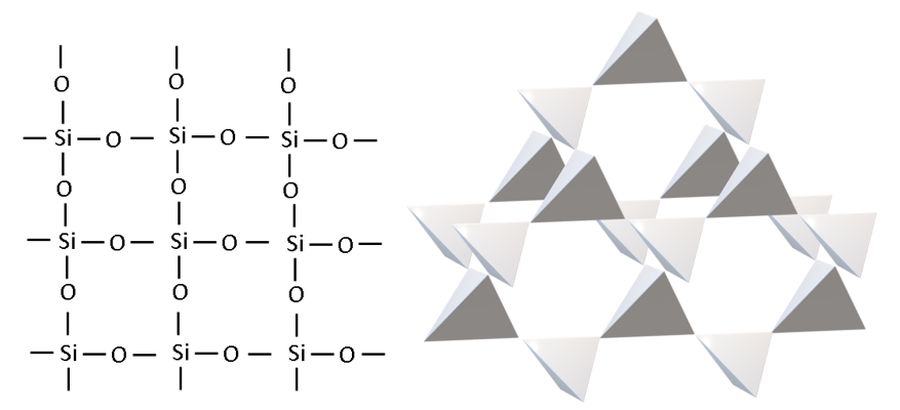
Bild 3: Zweidimensionales SiO2-Atomgitter und dreidimensionales Netzwerk aus tetraedrische SiO4-Baueinheiten
(Skizze: Lüttgens)
Könnte man alle Atome eines Sandkorns zählen, dann würde man feststellen, dass das Verhältnis zwischen Siliciumatomen und Sauerstoffatomen genau 1:2 wäre – entsprechend der Verhältnisformel SiO2.
Schauen wir uns nun die Oberfläche eines Sandkorns genauer an: Es handelt sich um eine Grenzfläche, an der die fehlenden Siliciumatome an den Bindungsstellen der Sauerstoffatome ersetzt werden müssen. Diese Aufgabe nehmen Wasserstoffatome war.
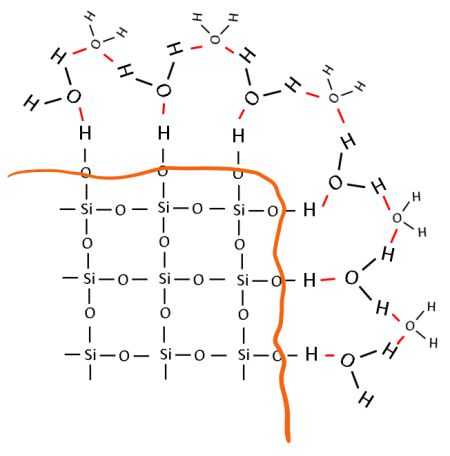
Bild 4: Modell der hydrophilen Oberfläche eines Sandkorns in Wasser (Grenzfläche orange gezeichnet, Wasserstoffbrückenbindungen rot gezeichnet)
(Skizze: Lüttgens)
Die Wasserstoff- und Sauerstoffatome an der Grenzfläche des Sandkorns können wiederum mit angrenzenden Wassermolekülen wechselwirken, indem sie sogenannte Wasserstoffbrückenbindungen eingehen. Jetzt verstehen wir, warum „normaler“ Quarzsand hydrophil ist.
Die „Sandformel“ des magischen Sandes – genauer betrachtet
Als Material wird auf den Verpackungen für Kinetic Sand angegeben: 98-99 % Sand, 1-2 % polymeres Bindemittel, mit der Abkürzung PDMS. Das steht für Polydimethylsiloxan. Das lankettige Makromolekül, hergestellt aus dem Monomer Dichlordimethylsilan, ist nichts anderes als ein einfaches Silikonöl. Doch das verändert die Sandkörner entscheidend. Aber wie?
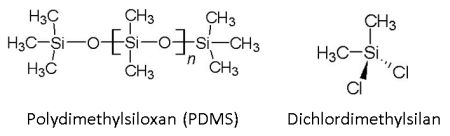
Bild 5: Das Polymer Polydimethlysiloxan PDMS wird aus Dichlordimethylsilan synthetisiert.
(Skizze: Lüttgens)
Betrachten wir wieder die Oberfläche eines einzelnen Korns diesmal des magischen Sandes. Durch den Zusatz des Silikonöls muss die Grenzfläche chemisch so verändert worden sein, dass der sogenannte „oberflächenfreundliche, magische Sand“ entsteht. Wie kommt es zur Bindung zwischen Quarz und PDMS? Auffällig ist, dass nun keine freien OH-Gruppen mehr die Grenzfläche bilden. Vielmehr umschließen zahlreiche Methylgruppen -CH3 das Sandkorn wie eine Art wasserabweisender Schutzfilm.
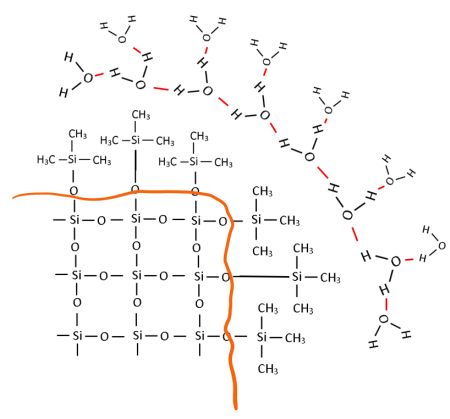
Bild 6: Modell der hydrophoben Oberfläche eines „magischen“ Sandkorns in Wasser (Grenzfläche orange gezeichnet, Wasserstoffbrückenbindungen rot gezeichnet)
(Skizze: Lüttgens)
Jetzt verstehen wir, warum sich „magischer“ Sand hydrophob verhält: Die mit Methylgruppen an der Oberfläche „beschichteten“ Sandkörner können keine Wasserstoffbrückenbindungen mit den sie umgebenden Wassermolekülen eingehen – sie sind dazu einfach zu unpolar. Folglich wird Wasser an der Oberfläche der behandelten Sandkörner regelrecht „abgewiesen“; das Wasser perlt nun ab.
Für Spezialisten: Ein bisschen Thermodynamik
Klären wir nun die Frage, warum der hydrophobe Sand im Wasser zusammenklumpt.

Bild 7: In Wasser klumpt hydrophober Sand zusammen, Quarzsand verteilt sich hingegen fein
(Foto: Lüttgens)
Häufig hört man zur Erklärung für diese hydrophobe Wechselwirkung folgendes: Die mit Polymethylsiloxan behandelten Sandkörner haften dank der zahlreichen, an den einzelnen Körnern außen liegenden, hydrophoben Methylgruppen zusammen. Ursache sind die, wenn auch jeweils schwachen, van-der-Waals-Kräfte, die mit zunehmender Kettenlänge jedoch einen spürbaren Effekt haben können. Das „Silikon“ soll dann wie eine Art Kleber zwischen den Sandkörnern wirken.
Tatsächlich ist die Erklärung etwas komplizierter. Thermodynamisch gesprochen ist das Zusammenklumpen des magischen Sandes ein spontaner Prozess. Wir müssen von außen keine Arbeit verrichten. Spontan verläuft ein Prozess, wenn die Änderung der Freien Energie ΔG negativ ist. In der sogenannten Gibbs-Helmholtz-Gleichung
ΔG = ΔH - TΔS
gibt es zwei Terme: ΔH und TΔS. Ist ΔH negativ, spricht man von einer exothermen Reaktion, bei der Energie frei wird. In unserem Falle erwärmt sich jedoch das Wasser nicht, sodass die Enthalpieänderung ΔH nicht ins Gewicht fallen kann.
Schauen wir uns nun den zweiten Term TΔS an. Die thermodynamische Zustandsgröße S – Entropie genannt – ist ein Maß für die Ordnung eines Systems. Nimmt ΔS positive Werte an, nimmt die Ordnung eines Systems ab, das Chaos zu. Denn der zweite Hauptsatz der Thermodynamik besagt, dass chemische und physikalische Prozesse stets in die Richtung verlaufen, in der die Unordnung eines Systems – in unserem Falle bestehend aus zwei Komponenten, dem Wasser und dem hydrophoben Sand – zunimmt.
Wie kann es dann sein, dass sich die hydrophoben Sandkörner zusammenklumpen? Von Chaos und Unordnung ist doch keine Spur! Müssten sich die vielen einzelnen Körner nicht im Wasser willkürlich und unregelmäßig verteilen, wie es die erste Skizze zeigt? Seltsam ist, dass der Prozess genau in die umgekehrte Richtung verläuft, in Richtung zunehmender Ordnung: Die Ordnung nimmt sichtbar deutlich zu, wenn sich die einzelnen Körner im Wasser zu einem Klumpen zusammenfinden.

Bild 8: Nimmt die Entropie ab, wenn magischer Sand im Wasser zusammenklumpt?
(Foto: Lüttgens)
Schauen wir uns die Situation auf der Ebene der kleinsten Teilchen genauer an.
Die Wassermoleküle gehen untereinander sehr starke Wasserstoffbrückenbindungen ein. Fällt nun ein einzelnes Korn des hydrophoben Sandes in das Wasser, dann müssen einzelne Wassermoleküle an der Grenzfläche verdrängt werden. Das geht nur, wenn die starken Bindungen dort aufbrechen - und an anderer Stelle möglichst neu geknüpft werden. Jedoch sind diese Möglichkeiten rund um das hydrophobe Korn deutlich geringer als in reinem Wasser. Die Bilanz sieht aus thermodynamischer Sicht also für die Wassermoleküle schlecht aus, weil deren Ordnung zunimmt. Anders gesagt: Rund um ein einzelnes Sandkorn müssen sich die Wassermoleküle stärker ordnen als im restlichen Wasser. Was passiert, wenn nun ein zweites Sandkorn hinzukommt? Es könnte sich irgendwo verteilen oder mit dem ersten Korn gemeinsam ein größeres Korn bilden. Und genau das passiert. Denn nun sind weniger Wassermoleküle streng geordnet, als wenn sich zwei einzelne hydrophobe Sandkörner in dem Wasser verteilen würden, um die sich dann die Wassermoleküle streng anordnen müssten.
Energetisch günstig ist der hydrophobe Sandklumpen im Wasser. Denn die Unordnung nimmt im Wasser gleichzeitig enorm zu, während sie im geklumpten Sand abnimmt. Insgesamt ist also die Entropieänderung ΔS deutlich positiv und folglich die freie Energie ΔG negativ. Und damit verläuft der Prozess spontan ab, wie wir ja im Experiment beobachten konnten.
Last but not least
Zum Schluss muss noch etwas aus eigener Kindheitserfahrung gesagt werden: Reiner (also farbloser) Quarzsand kann nicht zum Burgenbauen verwendet werden, da er nicht „backt“ (vgl. Bild 1 oben). Die H-Brücken reichen also nicht aus. Viel besser für den Burgenbau ist der gelbliche Sand z. B. aus dem Baumarkt geeignet. Dieser ist durch Verwitterung von Basalt, Granit und anderen silikatischen Mineralgemischen entstanden. Er enthält neben Quarz eine Vielzahl von anderen Mineralien, die ionische Ladungen aufweisen. Somit kommt es nicht nur zur Ausbildung von H-Brücken, sondern dazu auch zu ionischen Wechselwirkungen, die viel stabiler sind und so die „Backfähigkeit“ des Sandkasten-Sandes fördern.
Mein Fazit: Ein wenig Chemie entzaubert zwar das Verhalten des magischen Sandes. Dem Spieltrieb – ob beim Burgenbauen im Wohnzimmer auf dem guten Teppich oder draußen im Sandkasten – sollte dies jedoch keinen Abbruch tun.
Quellen:
[1] CRAZE GmbH –Magic Sand, https://craze.toys/produkt-info.php?productitems=164 (abgerufen am 26.02.2019)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 1. April 2019, Fritz Meiners